细胞膜包裹的纳米颗粒在疾病治疗中的应用
摘要
纳米技术因为其巨大的发展潜力,在医学应用中受到广泛关注,然而纳米颗粒容易触发宿主免疫清除系统,导致其无法达到预期治疗效果甚至产生毒副作用。近年来,使用细胞膜包裹纳米颗粒被证明可以有效地使纳米颗粒逃过免疫系统的清除。使用细胞膜包裹纳米颗粒,既能使纳米颗粒获得天然细胞膜的理化特征,还能使其具有膜来源细胞的锚定蛋白、抗原等生物学特征,从而实现免疫逃逸、长循环、药物靶向释放和调节免疫等独特能力,极大地增加了其在生物医学应用中的灵活性和可能性。本文综述了细胞膜包裹的纳米颗粒在疾病治疗中的应用现状,分析了这一新平台潜在的巨大应用价值,并描绘了这一新平台未来在疾病治疗中的前景。
纳米颗粒是指直径在1−100 nm的粒子聚合体,是处于该几何尺寸的各种粒子聚合体的总称。近年来,已有多种纳米材料用于纳米颗粒的制备,不同纳米材料因其本身所具有的特性应用于不同场景。例如,明胶、纳米凝胶、脂质体和聚合物制成的有机纳米颗粒,最常见的是聚乳酸-羟基乙酸共聚物纳米颗粒,因其高效的载药能力、良好的生物相容性与可降解性等优点,被广泛应用于靶向递送药物。无机纳米材料,如金纳米颗粒、银纳米颗粒、介孔二氧化硅、碳纳米材料和金属有机框架(metal-organic frameworks, MOFs)等,因合成简单、造价便宜、自身具有独特的光、电、磁等特性,被广泛应用于成像、光热治疗、光动力治疗等领域。
随着纳米技术的发展,纳米颗粒这种尺寸小、功能灵活和负载能力强的新兴系统在生物医学相关领域初现潜力。通过改变纳米颗粒的材质或结合特定配体,赋予纳米颗粒不同能力,以达到药物递送、靶向治疗、肿瘤诊断等目的。但免疫清除导致的纳米颗粒半衰期短是该系统面临的最大挑战。为改善这一问题,在纳米颗粒表面涂层聚乙二醇(polyethylene glycol, PEG)被认为是纳米颗粒隐身的金标准,它在纳米颗粒表面形成一个水化层,减少其与环境的相互作用,显著增强纳米颗粒的循环时间,但有报道称PEG涂层的纳米颗粒重复给药会诱导免疫应答,产生PEG抗体,影响多次给药性能并增加被免疫系统清除的风险。对此,研究者们使用合成高分子物质和天然高分子物质替代PEG以达到更好的免疫逃逸效果。Hu等开创了一种高效的细胞膜挤出涂层技术,利用天然细胞膜包裹纳米颗粒,使纳米颗粒获得天然细胞膜的理化特征,同时具有膜来源细胞的生物学特征以及部分生物学功能,因此可以实现免疫逃逸,延长在动物体内的半衰期。近年来,有研究人员利用基因工程技术对细胞膜进行改造,增强其原有功能或赋予额外的功能配体,以达到加强靶向作用、进一步延长循环时间的效果。通过特定的修饰,经过改造的细胞膜包裹的纳米颗粒在生物医学应用中展现出更大的潜力。利用不同的细胞膜包裹纳米颗粒可以赋予同种材质的纳米颗粒截然不同的生物医学功能。本文着重对基于细胞膜包裹的纳米颗粒这一平台在疾病治疗中的应用场景进行综述,以深入解读这一新型仿生策略灵活的功能。
1 细胞膜包裹的纳米颗粒的制备与表征
1.1 细胞膜包裹的纳米颗粒的制备
细胞膜包裹的纳米颗粒的制备主要分为3个部分:纳米核心的制备、细胞膜的提取、细胞膜与纳米核心的融合,每一步都是纳米颗粒功能化的关键。目前,乳化溶剂法和纳米沉淀法因具有操作简单、包封率良好、复现性好等优点被广泛应用于纳米核心的制备。细胞膜的提取通常采用低渗处理、反复冻融或机械破坏的方式使细胞裂解,然后通过差速离心或密度梯度离心去除胞内的可溶性蛋白,获得较为纯净的细胞膜提取物。细胞膜和纳米核心的融合通常采用薄膜挤压法、超声降解法和电穿孔法来实现。薄膜挤压法利用挤出器将细胞膜和纳米核心混合后,通过机械挤压的方式经聚碳酸酯膜挤压9−11次,便可将细胞膜均匀的覆盖在纳米核心表面。该方法快捷简便,但很难大规模制备。超声降解法是通过超声处理纯化的细胞膜和纳米核心使细胞膜包裹至纳米核心表面,此方法需对超声条件进行优化,在不使药物变性和泄漏的前提下,达到最大的包封率。电穿孔法利用微流控装置的电脉冲作用促进纳米核心进入细胞膜中,实现细胞膜与纳米核心的融合。除此之外,还报道了一种基于活细胞原位包裹纳米核心的方法,该方法将细胞与金纳米颗粒、铁离子或量子点等共孵育,细胞便可以分泌含有外源纳米颗粒的囊泡,但该方法尚未得到大规模应用。
1.2 细胞膜包裹的纳米颗粒的表征
细胞膜包裹在纳米核心表面后其直径、电子密度、表面电荷等都会发生改变,因此可对其理化性质和生物学特性进行表征,判断细胞膜是否成功包被纳米核心。透射电子显微镜(transmission electron microscopy, TEM)被认为是表征纳米颗粒形态的金标准,可以清晰观察到细胞膜包裹在纳米核心表面形成的核膜结构。电动电位(Zeta电位)可以反映包膜前后的表面电位变化。动态光散射(dynamic light scattering, DLS)通常用于表征纳米颗粒的稳定性及均一化程度。为验证细胞膜在纳米核心表面的生物学功能,利用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)和蛋白免疫印迹(Western blotting)等方法进一步检测细胞膜上特异性标记物的存在,类似的蛋白质图谱和蛋白质标记物的保存被认为是膜包裹后保留生物功能的良好标志。在不同的生物场景中,所应用到的仿生纳米颗粒的膜来源、核心材料、纳米核心载药能力等存在个体化差异,因此表征方法可根据仿生纳米颗粒的特性进行调整。
2 细胞膜的选择
不同的细胞膜可以赋予同种材质的纳米颗粒截然不同的生物医学功能,且在之前研究中发现细胞膜的来源与宿主亲缘关系的远近也会影响细胞膜包裹的纳米颗粒在生物体内的安全性。因此在实际应用时应根据细胞膜的特点和功能对细胞膜进行选择。例如,红细胞是机体血液中含量最多、寿命最长的血细胞,红细胞膜表面的整合素相关蛋白CD47可以抑制巨噬细胞的吞噬作用,从而逃逸免疫清除,延长在体内的循环时间。此外,红细胞膜表面还具有溶血素特异性受体,因此红细胞膜包裹的纳米颗粒被广泛应用于药物递送和中和溶血素。白细胞是一类包含了许多免疫细胞的血细胞亚群,主要包括巨噬细胞、粒细胞和淋巴细胞,在机体免疫中发挥着重要作用。白细胞膜继承了源细胞的自我识别机制和天然免疫识别受体,具有免疫逃逸和炎症趋向性,可以穿过血管壁靶向炎症和肿瘤部位,调节免疫应答,被广泛应用于治疗癌症和炎症性疾病。血小板是一种从巨核细胞胞浆脱落下来的无核胞质,在止血、肿瘤转移、机体固有免疫反应等生理活动中发挥着重要的作用。血小板具有良好的免疫逃逸能力和对损伤血管以及肿瘤组织的特异性黏附作用,且与动脉粥样硬化的形成与发生有关,因此用于治疗动脉粥样硬化、肿瘤和血管受损。肿瘤细胞膜在体外具有无限增殖、容易培养、可大量制备的优点,且免疫逃逸和同源靶向能力显著,被广泛用于肿瘤靶向治疗。杂化细胞膜同时兼具两种细胞膜的特性,能够在生理环境中协同执行复杂的生物活动,例如红细胞-黑色素肿瘤细胞杂化膜表现出长循环和靶向肿瘤的双重特性。
3 肿瘤或癌症治疗
纳米技术为肿瘤的治疗提供了巨大的机会。然而,在临床应用中,纳米颗粒在稳定性、靶向性等方面存在一定的局限性。细胞膜包裹的纳米颗粒这一平台的出现,不仅解决了这些问题,还为多种肿瘤的治疗提供了更加强大的材料支持。
3.1 增强光热治疗
光热疗法(photothermal therapy, PTT)作为一种很有前景的癌症治疗策略,利用了纳米材料的光热转换性能。光热疗法在肿瘤治疗中具有高效、无创、对正常组织无损伤等优点。然而,纳米颗粒在肿瘤部位的积累不足,是光热疗法面临的一大挑战。纳米颗粒可以通过细胞膜的包裹,实现特异的靶向作用,利用其这一优势,Han等利用叠氮化合物(azide, N3)标记的T细胞膜包裹负载光敏剂吲哚菁绿(indocyanine green, ICG)的纳米颗粒,试验结果显示注射N3标记的T细胞膜仿生纳米颗粒在肿瘤中的荧光信号显著增强,表现出明显的肿瘤积累,其荧光信号是未经N3基团修饰的T细胞膜仿生纳米颗粒的近2倍,表明通过标记在T细胞膜上的N3与标记在肿瘤细胞表面的靶向标签的生物正交反应,T细胞膜包覆赋予了纳米颗粒靶向识别肿瘤的能力,显著增强了纳米颗粒在肿瘤中的锚定(图1)。通过细胞膜及细胞膜上的修饰达到双靶向策略,促进了纳米颗粒与肿瘤的结合,有效地增强了治疗效果。

图1 叠氮化合物(N3)标记的T细胞膜包裹负载ICG的纳米颗粒治疗肿瘤示意图
3.2 增强光动力治疗
光动力疗法(photodynamic therapy, PDT)是一种新型的无创治疗方案,具有疗效强、靶向能力强、副作用小等优点,已被用于肿瘤的临床治疗。在光动力疗法导致的肿瘤细胞濒死时可以激活抗原呈递细胞(antigen presenting cells, APCs),刺激T细胞的产生和增殖,从而产生肿瘤免疫。然而,由于缺乏佐剂,单纯依赖治疗手段杀死肿瘤细胞并不能诱导产生效果明显且持久的免疫反应。Deng等利用自然杀伤细胞(natural killer cell, NK cell)细胞膜可以靶向癌细胞和具有细胞膜免疫诱导剂的特点设计了自然杀伤细胞膜包裹负载光敏剂的纳米颗粒。结果表明自然杀伤细胞膜赋予了纳米颗粒靶向癌细胞的功能,并且可以诱导细胞免疫反应,在光动力治疗的同时,诱导M1巨噬细胞极化产生抗肿瘤免疫反应,增强自然杀伤细胞膜包裹的纳米颗粒抗肿瘤免疫效率。
3.3 免疫治疗
癌症免疫治疗策略包括过继T淋巴细胞和免疫检查点阻断,在肿瘤的临床治疗方面有较为突出的效果。然而,过继T细胞治疗受制于昂贵且复杂的体外培养和个体间免疫差异等因素,免疫检查点阻断受制于该疗法引起的免疫相关不良反应、治疗效果有限等因素。Kang等设计了T细胞膜包裹负载抗癌药物的纳米颗粒,结果表明T细胞膜包裹的纳米颗粒可以通过黏附蛋白靶向肿瘤释放抗癌药物直接杀死肿瘤,甚至可以清除转化生长因子(transforming growth factor-β1, TGF-β1)和细胞程序性死亡配体1 (programmed death-ligand 1, PD-L1),重新激活细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)对肿瘤细胞进行杀伤。因其靶向性与T细胞膜蛋白,在研究中这种纳米颗粒可以在肿瘤局部比免疫阻断剂更高效地调节免疫,同时又避免了免疫阻断剂引起的免疫相关不良反应。
这些设计显示了细胞膜包裹的纳米颗粒的细胞膜来源的多样化、纳米颗粒核心灵活且可控的负载能力,使得细胞膜包裹的纳米颗粒作为肿瘤治疗平台有丰富的可能性,同时也展示了其在靶向递送药物与调节机体免疫方面的广阔前景。
4 外源性疾病
4.1 抑制细菌感染
近年来,临床上以革兰阴性杆菌为代表的多重耐药细菌的检出率呈快速上升趋势,为临床抗感染治疗带来巨大挑战。为降低抗生素的使用,能够与抗生素协同进行抗菌治疗的抗黏附剂已显示出有效的抑菌作用。Zhang等设计了利用幽门螺杆菌(Helicobacter pylori)外膜包裹的纳米颗粒,该仿生纳米颗粒继承了幽门螺杆菌的表面抗原从而模拟天然的致病菌。在研究中该纳米颗粒表面的幽门螺杆菌外膜携带的黏附素使其可以与宿主小鼠胃上皮组织粘连,通过竞争性的结合,阻碍幽门螺杆菌与小鼠胃组织的粘连,实现抗感染的目的。Angsantikul等还设计了胃上皮细胞膜如人胃腺癌细胞(human gastric adenocarcinoma cell, AGS cell)膜包裹负载抗生素的纳米颗粒(AGS cell membrane coated antibiotic- loaded polymeric nanoparticles, AGS-NPs) (图2A),结果表明胃上皮细胞膜所携带的受体可以与幽门螺杆菌靶向结合,发挥纳米颗粒药物缓释的功能有效杀伤幽门螺杆菌。若将两种纳米颗粒结合使用,有望呈现出针对细菌感染的抗黏附与抗生素的协同治疗。这一治疗方式无需抗黏附剂并且能够靶向缓释抗生素,为开发新的抗菌治疗平台提供了新的思路。除此之外,Deng等构建了表达Toll样受体4 (Toll-like receptor 4, TLR4)的巨噬细胞膜,并将其包裹在负载抗菌剂的纳米颗粒表面,制备巨噬细胞仿生纳米颗粒。此纳米颗粒对大肠杆菌(Escherichia coli)的吸附率约为未包膜纳米颗粒的5倍,从而实现靶向释放药物,达到更好的抑菌效果。纳米颗粒表面携带的TLR4竞争性中和微环境中的脂多糖(lipopolysaccharide, LPS),抑制促炎巨噬细胞活化,实现抗菌和免疫调节的双重功能。Pang等通过基因工程技术,制备了表面具有金黄色葡萄球菌(Staphylococcus aureus) α-溶血素(α-hemolysin, Hla)抗体的细胞膜,并在其内部封装声敏剂制成的纳米颗粒。该纳米颗粒表面携带的抗体高效中和细菌的毒力因子,靶向细菌感染部位,利用声动力疗法 (sonodynamic therapy, SDT)超声产生活性氧高效杀死细菌,实现抗菌和抗毒素的同时治疗。该研究首次将抗菌声动力疗法与免疫疗法联合使用,无需使用抗生素便可高效地中和细菌毒力因子并清除细菌。
4.2 中和毒素
病原菌或有毒动植物分泌的蛋白质毒素可以突破细胞膜屏障产生毒力作用。传统的抗毒素方法主要依赖于结构特异性平台,例如用于毒素中和的抗体,这种方法虽然有效,但由于毒素的多样性,有效的抗毒素治疗需要同时施用多种制剂。这就导致了结构特异性抗毒力平台的临床应用有很强的局限性,从而显示出开发广谱抗毒素平台的重要性。大多数毒素对细胞膜的个别成分表现出一定程度的特异性结合,纳米颗粒外侧包裹的细胞膜同样具有这些成分。基于这些特性,细胞膜包裹的纳米颗粒有作为广谱毒素解毒平台的潜力。如Hu等设计的由人红细胞膜包裹的纳米颗粒,通过在纳米核心表面包裹细胞膜,从而伪装成毒素诱饵吸附游离的毒素,使其失去损伤其他组织细胞的能力,在研究中证明可以有效地中和蜂毒素(melittin, MLT)、金黄色葡萄球菌(Staphylococcus aureus) α-溶血素(α-hemolysin, Hla)、李斯特菌(Listeria monocytogenes)溶血素O (listeriolysin O, LLO)和链球菌(Ltreptococcus)溶血素O (ltreptolysin O, SLO)这4种成孔毒素(pore-forming toxins, PFTs)。本实验室设计的人红细胞膜包裹的纳米颗粒已经被证实可以治疗由产气荚膜梭菌(Clostridium perfringens) ε毒素(ε-toxin, ETX)引起的致命感染(图2B),并首次证实了吸入式纳米颗粒可以中和气溶胶感染的毒素,且人红细胞膜包裹的纳米颗粒捕获的毒素与该纳米颗粒在被消化之前对宿主的毒性也可忽略不计。相关研究表明,毒素被纳米颗粒吸附后失去毒性,且逐渐被肝脏和脾脏捕获。肝脏和脾脏是动物单核巨噬细胞系统(mononuclear phagocyte system, MPS)的重要组成部分,MPS捕获和分解功能可以确保毒素与纳米颗粒一起被清除。病理切片结果表明,毒素被纳米颗粒吸附后,不会对器官造成任何损伤。类似的设计和研究可以很容易地应用于其他细胞膜包裹的纳米颗粒平台,不同的细胞膜也会赋予纳米颗粒不同的功能,也就是说细胞膜包裹的纳米颗粒平台有望被开发成便捷有效的广谱毒素解毒平台。
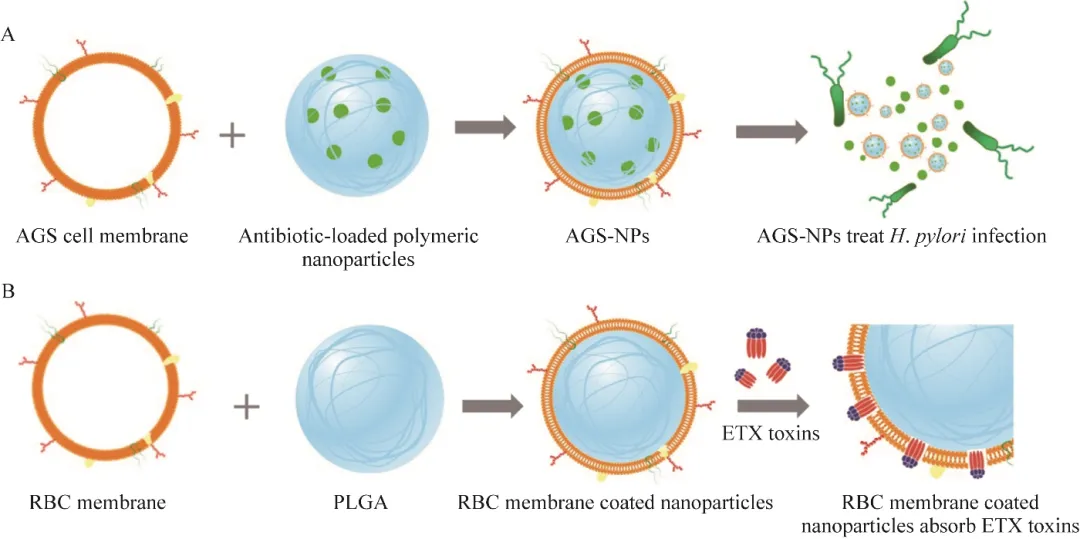
图2 细胞膜包裹的纳米颗粒治疗幽门螺杆菌和吸附ε毒素(ETX)示意图
A:人胃腺癌细胞膜包裹负载抗生素的纳米颗粒(AGS-NPs)治疗幽门螺杆菌感染示意图
B:人红细胞膜包裹的纳米颗粒吸附ETX毒素示意图
4.3 中和病毒
研制一款新型病毒的治疗药物是一个复杂且艰难的挑战,这是由于大多数传统治疗药物的研制需要了解病毒潜在的致病机制。并且,抗病毒药物通常只能针对特定的病毒,随着病毒突变的积累,抗病毒药物有失效的风险。而利用细胞膜包裹的纳米颗粒平台开展的抗病毒药物的研发重点在于宿主细胞,而不是一味地针对病原体。如在新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)暴发且变异株不断出现这一背景之下,Tan等设计了巨噬细胞膜包裹的纳米颗粒,其内部负载抗病毒药物。该纳米颗粒继承了巨噬细胞膜固有表面受体,竞争性结合促炎细胞因子白细胞介素-6 (interleukin-6, IL-6)和白细胞介素-1 (interleukin-1, IL-1),抑制免疫细胞激活和细胞因子风暴综合征(cytokine storm syndrome, CCS),有利于COVID-19的抗炎症治疗。此外,巨噬细胞膜表面的血管紧张素转换酶2 (angiotensin- converting enzyme 2, ACE Ⅱ)可以特异性靶向SARS-CoV-2刺突蛋白释放抗病毒药物,显著提高治疗效率,表现出优异的抗炎和抗病毒协同效应。Zhang等基于在前期研究中已经确定的新型冠状病毒靶细胞,设计的人巨噬细胞膜包裹的纳米颗粒与人肺上皮Ⅱ型细胞(human alveolar epithelial type Ⅱ cells)膜包裹的纳米颗粒2种抗新型冠状病毒药物,都能以剂量依赖的方式中和新型冠状病毒。此外,人巨噬细胞膜包裹的纳米颗粒在具有对病毒的中和能力的同时,还能够解决宿主的暴发性炎症。与其他的治疗方式相比,细胞膜包裹的纳米颗粒平台有着独特的优势,针对一种快速突变的病毒而言,只要病毒的目标依然是宿主相应的细胞,细胞膜包裹的纳米颗粒的治疗效果理论上就不会有明显的降低,也不会使病毒产生抗药性,其优秀的抗突变能力是传统治疗药物难以达到的,也是作为一种易突变病毒的治疗药物所必须具备的。虽然这一药物尚未应用在动物模型之上,但却能成为病毒治疗平台开发方向的重要参考。
5 其他疾病
5.1 类风湿性关节炎
类风湿性关节炎(rheumatoid arthritis, RA)是一种常见的慢性炎症性疾病,临床研究中使用针对炎症反应的治疗对策在近年来已经取得了一些成果,但其治疗效率仍未能令人满意。并且由于细胞因子相互作用的复杂性和细胞因子靶点的多样性,用于治疗的生物制剂的毒性仍然难以预料。Liu等利用小分子物质和细胞因子诱导成纤维样滑膜细胞(fibroblast-like synoviocytes, FLS)高表达多种抑制T细胞活化分子,并提取其细胞膜包裹纳米颗粒用于治疗类风湿性关节炎。研究结果显示该细胞膜包裹的纳米颗粒可以靶向炎症关节,通过多种途径抑制T细胞活化,显著减轻小鼠的炎症细胞浸润和滑膜增生,表现出良好的治疗效果。Zhang等设计了一种中性粒细胞膜包裹的纳米颗粒,该纳米颗粒继承了中性粒细胞的相关膜功能。结果表明,这些纳米颗粒可以中和促炎细胞因子从而抑制炎症,并且能够深入软骨基质为小鼠提供强有力的软骨保护。与现有的抑制特定点的抗细胞因子药物不同,中性粒细胞包裹的纳米颗粒无需识别细胞因子即可提供阻断、抑制炎症级联反应的能力。对于炎症反应的治疗,细胞膜包裹的纳米颗粒可以提供广谱抗炎症功能,这未尝不是其发展成为一种潜在的抗炎症平台的优势所在。
5.2 治疗眼部新生血管疾病
与病理性新生血管形成密切相关的眼部新生血管疾病是人失明的主要原因之一。这类疾病(如湿性年龄相关性黄斑变性、糖尿病视网膜病、早产儿视网膜病变)因血管生成过度而诱发出血、水肿、视网膜脱离,最终会导致患者视力丧失。目前临床上治疗这类疾病的策略主要为定期在玻璃体内注射抗血管内皮生长因子(vascular endothelial growth factor, VEGF)药物,尽管其显著降低了视力障碍患病率,但反复长期的侵入性注射存在患者依从性差、经济负担沉重、技术要求高和眼部并发症风险大等问题。为此Li等设计了由视网膜内皮细胞(retinal endotheliocyte cell, REC)膜与人红细胞(red blood cell, RBC)膜制成的杂化细胞膜包裹的纳米颗粒(图3),其表面的视网膜内皮细胞膜携带了VEGF受体,可用于中和VEGF,人红细胞膜能够赋予其免疫逃逸功能,使得该纳米颗粒在宿主体内拥有更长的半衰期;结果表明这一杂化膜包裹的纳米颗粒完全能够作为一种有效的血管生成药物,并且能够满足对新生血管性眼部疾病无创治疗的迫切需求。这一设计应用杂化细胞膜对纳米颗粒进行包裹,再次证明了细胞膜包裹的纳米颗粒平台具有丰富的可能性,这使其拥有发展成为疾病治疗领域重要平台的潜力。
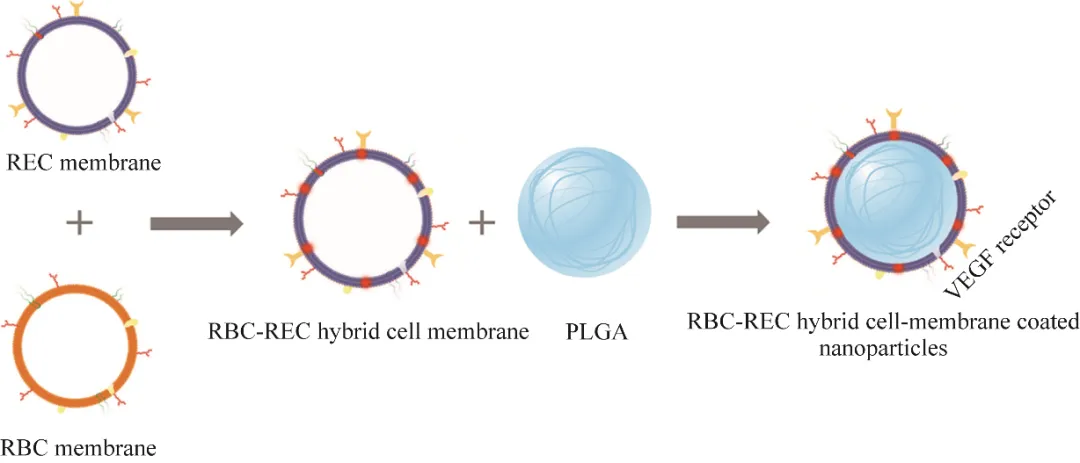
图3 视网膜内皮细胞(REC)膜与人红细胞(RBC)膜的混合细胞膜包裹纳米颗粒制备流程
6 讨论与展望
细胞膜包裹的纳米颗粒这一新兴平台,具有传统药物难以企及的灵活性。如表1所示,纳米颗粒表面包裹的细胞膜能赋予这些纳米颗粒不同的生物学功能,并且细胞膜作为脂质的流动性还允许后续应用生物分子对纳米颗粒进行功能化,核心材质的多样化同样支持纳米颗粒在不同应用场景中均能展现应用价值。
之前的研究发现,细胞膜包裹的纳米颗粒在体内与病原体快速结合后能够改变病原体在体内器官中分布与代谢。注射或吸入式的细胞膜包裹的纳米颗粒均能对宿主提供治疗作用,且预先注射或吸入细胞膜包裹的纳米颗粒能在短期内对宿主起到保护,实现化学药物难以实现的预防作用。较长的体内循环时间和良好的生物相容性使得细胞膜包裹的纳米颗粒在治疗过程中拥有更长的给药周期,提示其在体内药物递送、癌症治疗、病原体或其产物清除等方面同样具有较大的优势。对于外源性疾病而言,各类病原体或其产物的作用方式大相径庭,但其致病过程均会与细胞膜相互作用。传统治疗对策的有效程度大多与相应疾病的研究深度密切相关,这一痛点在治疗新型冠状病毒的相关研究中屡见不鲜,反观细胞膜包裹的纳米颗粒平台对外源性疾病的治疗,只要明确了与病原相互作用的宿主细胞,基于细胞膜包裹的纳米颗粒平台就能设计出相应的治疗对策。对于内源性疾病而言,将具有长循环时间、免疫逃逸、组织特异性靶向等功能和特性的细胞膜,与具有高效的载药能力和良好的生物相容性与可降解性的纳米核心联用,对于强化治疗效果或改善不良反应起到关键作用。
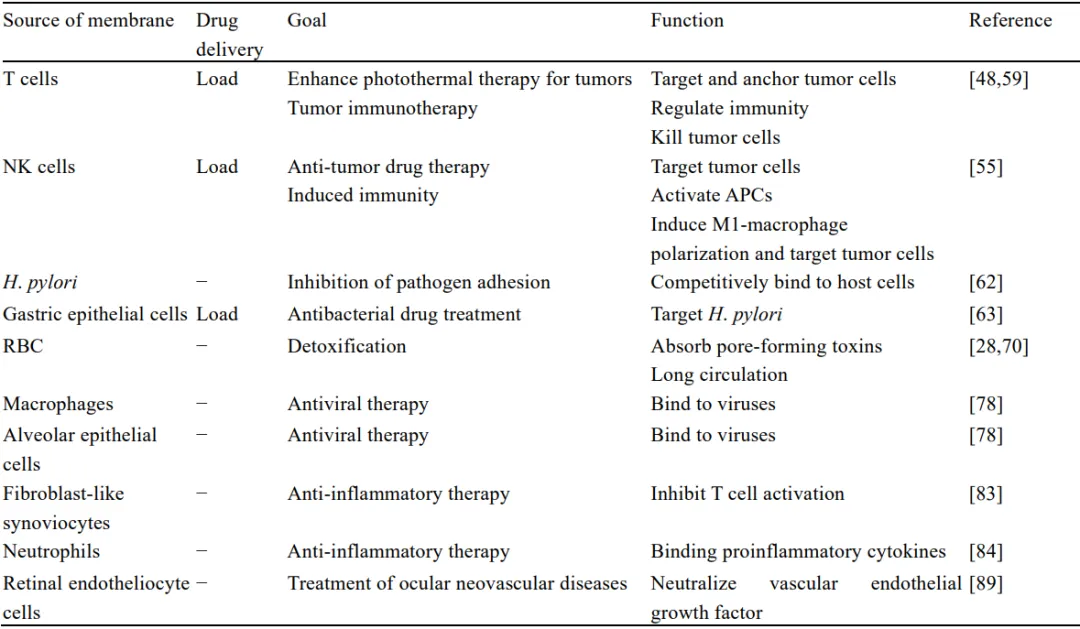
表1 不同来源细胞膜的生物学功能及应用
未来在生物医学应用中,细胞膜包裹的纳米颗粒将在疾病治疗方面显露出更大的优势。为了丰富细胞膜包裹的纳米颗粒平台的功能多样性,将有更多的天然细胞膜和基因编辑细胞膜被应用在这一平台中以开发新的应用场景;杂化细胞膜会更多地应用于这一平台并展现出其能够综合多种细胞膜生物学功能的优势,进一步增强和丰富这一平台的功能性;由生物分子功能化的细胞膜也会得到更多的应用,这些生物分子能够更好地发挥包裹纳米颗粒的细胞膜的优势性能。然而细胞膜包裹纳米颗粒平台还面临着大规模体外细胞培养、规模化生产困难等问题,距离临床应用之间存在着巨大差距。某些纳米颗粒因其自身特性或经过表面修饰后无法与细胞膜整合,会导致其功能化受到阻碍。一些细胞膜(如细菌细胞膜、肿瘤细胞膜)表面的锚定蛋白,例如免疫逃逸蛋白、细菌抗原等,是否会引发机体的不良反应还需继续研究。而且本实验室在前期研究中发现,细胞膜的来源与受试者之间的亲缘关系也与纳米颗粒的安全性有关,因此细胞膜的选择也是后续研究的一个重要方面。总之,细胞膜包裹的纳米颗粒具有较高的灵活性和传统药物难以企及的优势,应用前景广阔,但是细胞膜包裹的纳米颗粒的生物毒性、生物相容性、临床安全性等问题,也需要在后续研究中继续探究。
原文链接:https://cjb.ijournals.cn/html/cjbcn/2024/5/gc24051323.htm

