基于肿瘤微环境增强抗肿瘤治疗效果的纳米递药系统设计及应用
药物治疗是临床上治疗恶性肿瘤最常用的方法之一。传统的小分子抗肿瘤药物毒性高,进入体内后会通过血液循环分布于不同组织,产生非特异性的组织分布,不但降低了药物的有效浓度而且会引起诸如骨髓抑制、脱发等毒副作用,甚至导致治疗失败。此外,抗肿瘤药物的理化性质如溶解性、相对分子质量等也会对治疗效果产生影响,如姜黄素具有诱导肿瘤细胞凋亡的能力,然而,其水溶性差(约11ng·mL-1)、口服给药生物利用度低等缺陷限制了临床应用。由此可见,尽管现已研发大量具有抗肿瘤活性的药物,但如何使药物高效地发挥活性并减小毒副作用,成为现代医学领域的一项巨大挑战。
纳米递送系统能够有效克服药物溶解性差、靶向性差、毒副作用大、生物利用度低等问题,为改善药物递送效率提供了新思路。然而,纳米递送系统到达肿瘤部位发挥药效的过程受复杂的肿瘤微环境(tumormicr oenvironment,TME)影响,导致体内递送效率降低。由于TME与正常组织相比存在许多特殊之处,基于TME的独特特征设计纳米递药系统有望增强抗肿瘤治疗,一方面可以利用增强渗透和滞留效应被动靶向或配体-受体识别主动靶向至肿瘤组织,进而增加药物的渗透和积累;另一方面,通过响应微环境中弱酸性pH、乏氧等刺激源有助于实现药物的可控释放,避免递送过程中出现药物泄露。此外,调节TME也是克服递送障碍的一种有效策略,在肿瘤治疗中具有广泛的应用前景。因此,本研究总结了TME的组成及生物学特征,分别从靶向、响应及调节TME3个角度重点介绍基于TME特征所设计的纳米递药系统及其应用,并讨论其中存在的机遇和挑战。
1.TME
TME是肿瘤生长过程中所处的内环境,由各类细胞和非细胞成分相互交织形成,其内部的肿瘤细胞可通过循环、淋巴系统与周围细胞相互作用,从而影响肿瘤的生长。肿瘤细胞快速增殖和转移一直是临床治疗恶性肿瘤的难点,TME的存在为肿瘤的生长和发展提供了绝佳庇护所。TME的主要组成包括:①细胞外基质(ECM):为肿瘤生长提供结构支持。ECM通过逃避生长抑制因子、抵抗细胞死亡、诱导血管生成和激活侵袭、转移来促进肿瘤细胞增殖,ECM重塑并转化为对肿瘤有益的环境。致密的胶原网络降低药物在肿瘤细胞的穿透性,胶原纤维的动态厚度、ECM密度和基底膜的状态也会阻碍药物渗透到肿瘤深层区域。②癌症相关成纤维细胞(CAFs):激活后的CAFs能合成大量ECM成分,并通过释放蛋白水解酶如基质金属蛋白酶(matrixmetalloproteinases,MMPs)、去整合素等降解并重塑ECM。此外CAFs是许多生长因子和细胞因子如基质细胞衍生因子1(SDF1)、肝细胞生长因子(HGF)、血管内皮生长因子(VEGF)的重要来源,共同促进肿瘤发展和血管生成。③肿瘤相关内皮细胞(TECs):在肿瘤发生及保护肿瘤细胞免受免疫系统的识别中起到关键作用,研究表明肿瘤细胞能够触发TECs的免疫抑制活性,从而影响抗肿瘤免疫和治疗反应。与正常组织的内皮细胞相比,TECs在表型、功能和基因表达等方面均有明显差异,且肿瘤细胞中一些分泌因子如VEGF和成纤维细胞生长因子(FGF)能刺激TECs从而加速肿瘤生长。④免疫细胞(immunecells):包括先天免疫细胞(巨噬细胞、肥大细胞、中性粒细胞、树突状细胞、髓源抑制性细胞和NK细胞)和适应性免疫细胞(T、B淋巴细胞)。免疫细胞对肿瘤具有促进或抑制的双重作用,通过直接接触或趋化细胞因子信号传导来改变肿瘤行为。⑤周细胞(pericytes):一种包围着全身毛细血管内皮细胞的收缩细胞,该细胞嵌入毛细血管内皮细胞的基膜中,为内皮细胞提供结构支持;调控血管生成并加速肿瘤血管成熟。低周细胞覆盖率可能与肿瘤转移及不良预后相关,而高周细胞覆盖率则与侵袭性强、治疗较难的癌症相关。⑥血管:通常在原有的血管基础上延伸形成,血管生成在肿瘤的增殖和转移中起着至关重要的作用。一方面,肿瘤细胞释放VEGF激活血管内皮细胞,促进内皮细胞的增殖和迁移,另一方面内皮细胞旁分泌某些血管生长因子刺激肿瘤细胞的生长,肿瘤细胞和内皮细胞的相互作用贯穿于血管生成的全过程。这些新生血管为不断浸润生长的原发肿瘤提供营养,同时肿瘤细胞又分泌多种生长因子以加速新生毛细血管的形成(图1)。
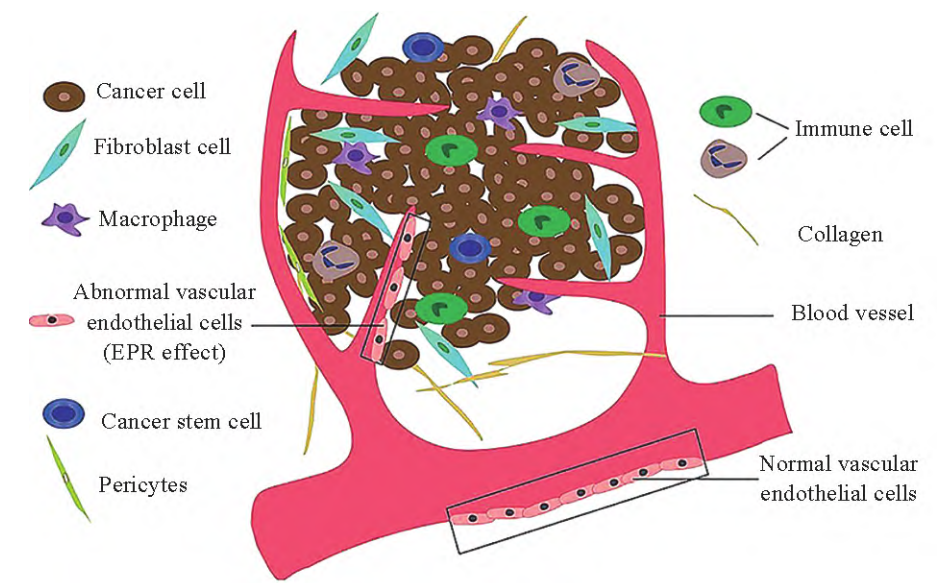
图1 肿瘤微环境(TME)的组成示意图
肿瘤复杂的微环境导致肿瘤部位表现出与正常组织不同的生物学特征。血管生成是肿瘤生长和转移的最基本条件,为肿瘤组织提供新陈代谢所必需的氧气和营养,然而新生血管持续且快速生长,导致肿瘤血管的形态和特征不同于正常血管,包括血管形状不规则,通透性强,结构缺乏完整性,内皮细胞间存在较大间隙等。由于肿瘤细胞的快速增殖和血管异常限制了氧的扩散,导致肿瘤组织内部的氧气含量低于正常水平,乏氧细胞也会过表达VEGF进一步加速新血管生成。在乏氧条件下,肿瘤组织的代谢由有氧代谢转化为无氧酵解,获得所需能量的同时产生酸性物质,大量的乳酸在细胞内蓄积使得肿瘤部位pH呈弱酸性(肿瘤细胞外pH6.5~7.0,正常组织pH7.4)。TME处还具有高浓度的还原性谷胱甘肽(glutathione,GSH)、不规则的酶水平等特征。此外,与正常组织相比,TME处会出现特异成分的表达或某些成分的过表达,例如肿瘤内皮细胞特异性表达肿瘤血管内皮生长因子受体(VEGFR)、αvβ3整合素和血管细胞粘附分子-1(VCAM-1);人乳腺癌细胞(MCF-7 cells)、人宫颈癌细胞(helacells)和人肝癌细胞(HepG2 cells)表面过度表达核仁素;MCF-7细胞表面过度表达叶酸受体等。利用TME的这些生物学特征可设计靶向性的和智能响应释放的药物递送系统,解决抗肿瘤药物应用中存在的缺陷以增强抗肿瘤治疗效果。
2.靶向TME的纳米递送系统
鉴于传统化疗药物在体内的非特异性分布,如何提高药物的组织选择性是递送过程中的首要问题。基于TME的生物学特征设计具有被动或主动靶向能力的纳米递送系统来增强药物到达肿瘤部位的能力,减少非靶向递送,是提高药物递送效率的有力措施。
2.1被动靶向的纳米递送系统
为了满足快速生长的需求,肿瘤部位的血管生长迅速,导致血管壁结构完整性差、间隙较宽,循环中的纳米递送系统可能穿透间隙进入肿瘤组织;同时,肿瘤组织的淋巴回流缺失也会造成纳米粒子的滞留,这种现象被称作肿瘤组织的增强渗透和滞留效应(enhanced permeability and retention effect),简称EPR效应(图2)。在EPR效应的影响下,纳米载药系统将抗肿瘤药物被动靶向递送至肿瘤组织,不仅能增强药物靶向性,降低全身毒副作用,还能改善疏水性药物和不稳定药物的使用限制。早在20世纪60年代末脂质体就被用于抗肿瘤药物递送,尽管脂质体具有良好的生物相容性、低细胞毒性等优势,但其结构属于热力学不稳定体系,且载药效果不佳。为了获得更强的载药能力和稳定性,迄今为止已开发出多种类型的纳米递送系统(图2),如聚合物纳米粒子因其良好的稳定性和负载能力成为常用的纳米递送系统之一;无机纳米粒子因其优良的物理化学性质,如大表面积、低毒性副作用和对大多数有机溶剂的耐受性也被广泛用于肿瘤治疗;此外,纳米凝胶、纳米级金属有机框架(NMOF)等新型纳米结构也逐渐成为研究热点。
如Guo等利用超声乳化技术制备了一种新型的蛋白石页岩纳米粒子(OPNPs),其多孔结构和较强吸附性有利于多柔比星(DOX)的包载和持续释放,延长药物在体内的血液循环并减少对正常组织的毒副作用。与游离药物相比,该载药系统显著改善了MCF-7细胞对DOX的摄取能力,并且OPNPs与核膜具有强结合能力,DOX可在细胞核定位作用下诱导MCF-7细胞凋亡,进一步抑制肿瘤生长。Xu等将局部覆盖斑块状金的异硫氰酸荧光素(FITC)二氧化硅纳米颗粒封装于介孔二氧化硅中,设计一种具有荧光成像和药物递送能力的新型蛋黄-壳结构的介孔二氧化硅纳米粒子(PAFS-YMSNs)。与传统选择性蚀刻不同,其多功能硅芯保持完整,碱性蚀刻主要发生在杂化层,导致YMSN形成空隙,利用DOX和硅基质表面电荷间的强静电相互作用,将药物包载于空隙和介孔二氧化硅壳层中。给药后通过光学成像系统实时监测小鼠肿瘤周围FITC的荧光强度,结果显示肿瘤周围PAFS-YMSNs的荧光强度随时间的推移而增加,证明该纳米递送系统可以通过EPR效应增强肿瘤组织的积累量,为构建肿瘤治疗的纳米平台提供了一种替代方案。厄洛替尼(Er)是一种靶向表皮生长因子受体(EGFR)的小分子疏水药物,用于治疗晚期或不可切除的非小细胞肺癌(NSCLC)。
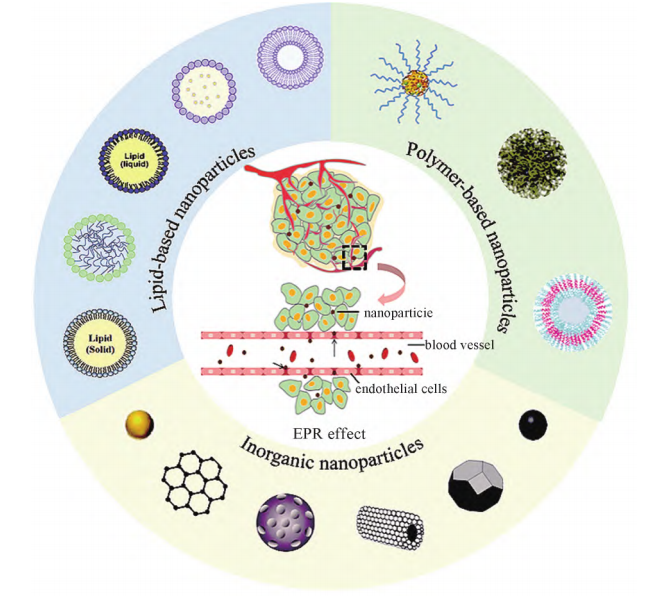
图2 基于增强渗透和滞留效应(EPR)效应的纳米递送系统
作为一线的EGFR抑制剂,Er的低水溶性和渗透性严重阻碍其疗效和临床使用。为此,Wang等提出了第一个DNA纳米结构接枝Er分子用于肿瘤治疗的方案。将Er与叠氮化物(N3)修饰的DNA链共价偶联后,在空间可编程的6×6×64ntDNA纳米结构上自组装,形成一种新型抗肿瘤药物递送系统。在纳米DNA结构的高溶解度、强细胞内化能力和EPR效应的作用下,Er的生物利用度明显提高,观察到6×6×64nt-Er纳米结构对A549细胞的细胞毒性增加,体内研究也表现出很强的抑瘤效果,且对小鼠的其他组织无明显损伤,这种新型递送系统可能在未来临床转化中显示出巨大潜力。
基于EPR效应,目前已有多种纳米载药系统被FDA批准上市,如多柔比星脂质体(DoxilⓇ)、白蛋白结合型紫杉醇等,但是由于TME复杂的病理特征,递送过程仍有很多不足,如靶向性低、肿瘤渗透性差以及非特异性药物释放等,削弱了抑制肿瘤的能力。并且EPR效应具有高度异质性,不同类型的肿瘤之间、甚至在相同的肿瘤肿块内均存在较大差异。最重要的是,临床观察表明,EPR效应在患者之间表现出显著的个体差异,甚至对某些患者无效,这些不确定性因素使得现阶段对EPR效应的研究主要停留在动物水平。由此可见,在临床应用中仅依赖EPR效应靶向肿瘤组织的策略仍有不足之处,需要进一步优化纳米递送系统的设计和性能,开发更有效的方法将抗肿瘤药物递送至靶部位。
2.2主动靶向的纳米递送系统
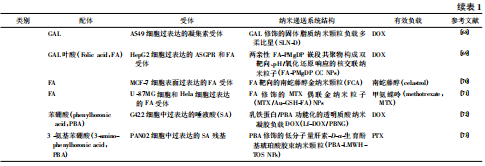
由于TME会产生特异性成分的表达或某些成分的过表达,根据此特点可在纳米递送系统的表面修饰能识别肿瘤部位特定受体的靶向配体,靶细胞上独特的受体和相应配体的识别为纳米载体的“识别与结合”功能提供了分子基础,不但增强纳米载体对肿瘤细胞的靶向及内化能力,还能改善纳米递送系统的体内循环时间、组织分布和肿瘤细胞的摄取等。总结基于主动靶向作用的纳米递送系统(表1),根据修饰的配体不同一般可分为以下类别:①抗体及其片段;②适配体(aptamers,Apts)和其他核酸序列;③肽或整个蛋白质;④小分子,如叶酸、苯硼酸和糖等。与被动靶向的纳米递送系统相比,主动靶向最大的优势是能够提高EPR效应。主动靶向的纳米颗粒进入肿瘤间质后,对肿瘤细胞的特异性识别作用可以降低间质中游离纳米颗粒的浓度。此外,相应的受体必须在肿瘤细胞表面过表达或特异性表达,且在正常细胞中表达减少,以便提供更多的配、受体结合位点。综上所述,配体修饰的主动靶向递送系统选择性的增加了有效载荷在肿瘤部位的积累,增强靶细胞递送效果。尤其是当抗肿瘤药物需要主动胞转肠黏膜、血-脑屏障等生理障碍或组织积累不依赖于EPR效应时,主动靶向性的药物递送系统具有不可替代的作用。
表1基于主动靶向作用的纳米递送系统

3.响应TME控制释药的纳米递送系统
一般情况下药物递送系统会在体内长循环过程中逐渐释放包载的药物,具有缓慢外渗能力的纳米载体到达TME时,相对较小的有效载荷会导致药效降低,因此,如何控制纳米递药系统中的药物在特定肿瘤部位有效释放同样是抗肿瘤药物递送过程中需要解决的重要科学问题。为了精确控制释药,递送系统需在血液循环过程中保持稳定并且具有刺激响应性,能识别细微的环境变化的同时做出响应。与正常组织相比,TME具有偏弱酸性、乏氧、高GSH浓度等特点,围绕这些特征设计响应TME的抗肿瘤药物递送系统,在内源性刺激下控制药物释放,从而有针对性的在体内病变区域实现“按需给药”,避免给药后由于长时间血液循环而导致的药物泄漏,使到达肿瘤部位的药物剂量明显提高,全身性毒性随之减少。
3.1pH响应
由于肿瘤组织与正常组织处的pH存在差异,因此可利用TME的弱酸性特征设计pH响应的抗肿瘤药物递送系统,如Dong等制备了具有聚集诱导发光(AIE)和福斯特共振能量转移(FRET)效应的pH/GSH双响应的超分子纳米递送系统(HG/CD@DOX),以多支聚酰胺(H-PAMAM)为核心,分支结构形成大量空腔用于包载DOX,H-PAMAM固有的AIE效应以及HG/CD载体与DOX之间的FRET效应可以动态监测药物递送系统的轨迹和药物释放过程。体外释药研究显示HG/CD@DOX在正常生理条件下释药量小于20%,pH为5.0时由于H-PAMAM本身的pH敏感性,在弱酸性环境中的结构相对松散,释药量可达75%以上,而高浓度GSH的存在会破坏超分子结构中的二硫键,进一步促进药物释放。细胞毒性结果显示,当HG/CD质量浓度达到2mg·mL-1时,细胞活力仍在90%以上,而载药后的HG/CD@DOX对MCF-7细胞显示出强大的杀伤作用,证明HG/CD超分子组装结构具有良好的生物相容性和药物递送能力。Wang等开发一种由β-拉帕醌(Lap)、pH响应的聚合物和活性氧(ROS)响应的DOX前药组装成的双响应纳米递送系统。肿瘤处的弱酸性环境刺激递送系统分解,释放的Lap通过芬顿反应产生毒性的氢氧根自由基,进而触发ROS响应的前药分解并释放DOX。体内实验结果表明ROS的产生和抗肿瘤药物的释放级联能有效抑制肿瘤的生长。Zhang等利用两亲性三嵌段共聚物mPEG-b-PGCA-b-PGTA设计一种多阶段协同药物递送纳米平台,以实现蛋白质和化疗药物的共递送(图3)。ROS敏感键将亲水性核糖核酸酶A(RNaseA)与苯硼酸基团连接形成RNBC,pH敏感的苯硼酸-儿茶酚键将RNBC与PGCA共价偶联,在自组装过程中通过疏水相互作用使DOX包载于载体内部,由此产生的动态锁定纳米颗粒具有较强稳定性,有助于延长血液循环时间,提高肿瘤积累量。经细胞内化后,pH敏感键在酸性内体-溶酶体中裂解释放RNBC;同时三胺的质子化介导DOX的释放,一方面促进RNBC从溶酶体逃逸到细胞质,另一方面诱导肿瘤细胞凋亡并增加细胞内ROS水平,促使ROS响应的RNBC转化为天然RNaseA,在小鼠黑色素瘤模型中响应性释放的DOX和RNaseA表现出显著的协同抗肿瘤作用。与其他治疗组相比,NP-DOX-RNBC处理的小鼠生存时间最长,体重无明显下降。
可逆质子化/脱质子化体系也被用于pH响应的药物递送系统的设计,两性离子-阳离子电荷转换嵌段如酰基磺酰胺、羧酸甜菜碱等是很好的候选片段。Mizuhara等开发了一种基于烷氧基苯基酰基磺酰胺的pH响应两性离子配体,其在生理条件下保持中性,在肿瘤弱酸性条件中带正电荷,明显增强肿瘤细胞的摄取。L-组氨酸(His)是一种pKb为6.5的氨基酸,也是一种典型的质子化/去质子化配体,能够响应肿瘤弱酸性环境。Bae等制备了一种含L-组氨酸和生物素的载DOX系统,当6.5<pH<7.0时生物素暴露在胶束表面,能够识别细胞。当pH<6.5时胶束不稳定,导致药物释放加快,破坏细胞膜。Wang等组报道了一种以叔胺取代基为检测单元的超灵敏的pH响应荧光胶束结构,该结构能够快速响应肿瘤外环境中低于0.25个pH单位的差异,进而精确控制释药。
3.2乏氧响应
肿瘤细胞的过度增殖能够加速氧气消耗,使得大多数实体肿瘤具有乏氧特征(实体肿瘤内氧压力可接近0mmHg,正常组织中氧压力约为30mmHg),乏氧细胞远离血管,在治疗过程中不能有效的与抗肿瘤药物接触,导致化疗效果不佳。为了克服乏氧产生的递送障碍,Thambi组以PEG作为
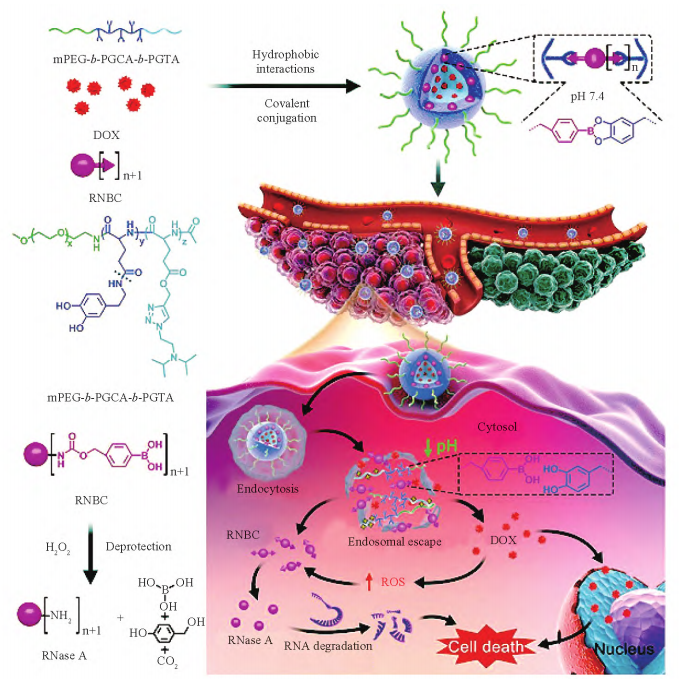
图3 两亲性三嵌段共聚物形成的多阶段协同药物递送纳米平台共递送蛋白质和化疗药物示意图
亲水部分,以低氧敏感的氯甲酸硝基苄酯共轭聚(赖氨酸)(pLys-g-NBCF)为疏水部分,自组装形成乏氧触发的胶束载药系统(DOX-HS-PMs)。通过比较乏氧状态下DOX-HS-PMs和无响应性的载药系统的释药行为发现,乏氧响应的递送系统中DOX释放率显著增强,且细胞内释药结果与体外释放行为一致。Qian等开发了新型乏氧响应的共轭聚合物载药系统(DOX/CP-NINPs),利用化疗和光动力治疗(PDT)联合抑制肿瘤生长。该载药系统由三部分构成:ROS生成和乏氧敏感的2-硝基咪唑接枝共轭聚合物(CP-NI)、聚乙烯醇基表面涂层(PVA)和封装药物DOX(图4A)。光照产生的ROS诱导环境进一步缺氧,在乏氧状态下疏水性2-硝基咪唑转化为亲水性2-氨基咪唑促使载药系统解离释药。如图4B所示,通过共聚焦激光扫描显微镜(CLSM)观察Hela细胞内DOX的释放情况,结果证实光触发产生的ROS既能损伤核内体及溶酶体膜来实现DOX/CPNINPs的有效逃逸,又能产生局部缺氧条件刺激DOX释放,细胞核内可观察到强烈的红色荧光。为了获得最佳疗效,Zhou等将乏氧激活的PTX前药(PTX2-Azo)包埋于光敏剂Ce6修饰的肽共聚物中得到新型纳米递送系统(Ce6/PTX2-AzoNP),一方面防止药物在体内过早泄露,另一方面在乏氧条件下具有缺氧敏感基团的生物还原性前药可以被活化释放。静脉给药后,Ce6/PTX2-AzoNP通过长循环效应聚集在肿瘤部位,乏氧环境促使部分PTX释放,随后光照激活Ce6产生单线态氧(1O2)诱导细胞凋亡,同时PDT加快耗氧进一步刺激释药。注射30h后小鼠的体内成像显示肿瘤区域仍存在可见的荧光信号,而其他器官无明显荧光,证明该纳米粒子能够在肿瘤部位有效积累并实现乏氧响应释药,在临床应用中具有十分广阔的前景。
3.3GSH响应
TME中的GSH浓度可达2~10mmol·L-1,而正常组织处GSH浓度仅为2~10μmol·L-1,由于肿瘤组织GSH浓度远远高于正常组织,巨大的GSH浓度差有利于氧化还原刺激响应的新型纳米递药系统的应用。其中,二硫键容易被GSH裂解,常用于氧化还原响应型药物递送系统设计。Moghaddam等合成一种外层含二硫键的中空介孔二氧化硅纳米粒子(HMSiO2 NPs),其体外模拟释药研究显示HMSiO2NPs的释药率是无GSH响应的纳米粒子的3倍。Wang等将低分子量寡聚物(LPEI)自组装到MSN表面,利用GSH敏感性的交联剂N,N'-双(丙稀酰)胱胺(BAC)使LPEI涂层原位交联,制备具有电荷转换能力的新型pH/GSH敏感的递送系统,表面交联的LPEI涂层能够有效减少药物的非特异性释放,在正常生理条件下的释药量仅为(6±2)%,而肿瘤部位高浓度GSH可诱导药物释放,显著增加细胞内的药物积累量以及抗肿瘤毒性。除了利用二硫
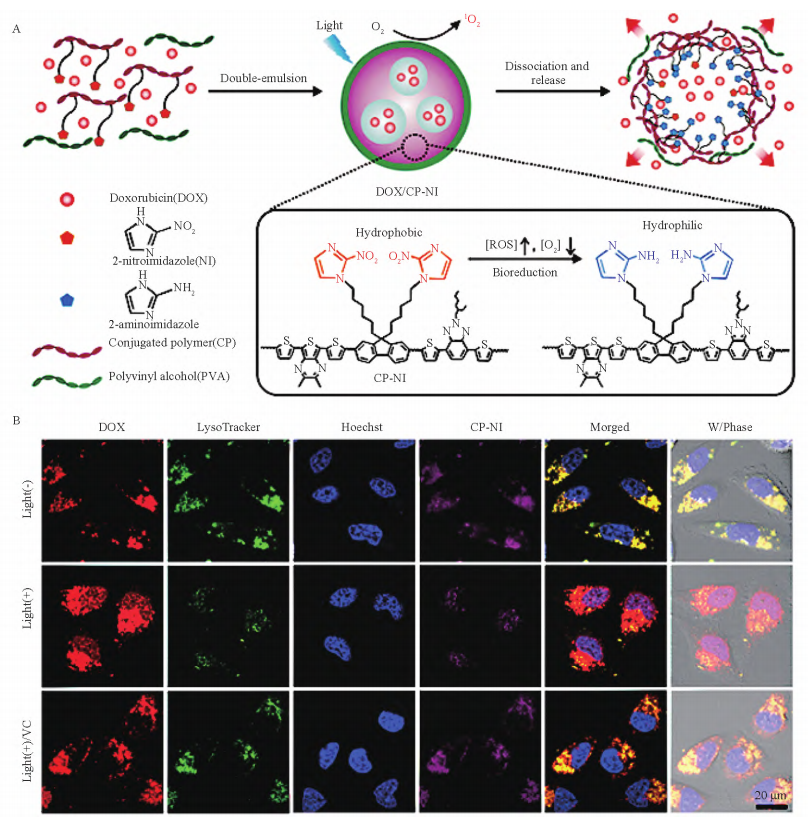
图4 DOX/CP-NI纳米粒子的形成及机理
(A) ,共聚焦激光扫描显微镜(CLSM)观察DOX/CP-NI纳米粒子在不同条件
(B) (无光、有光和ROS清除剂VC)处理的HeLa细胞中的递送情况
(C) (B)核内体和溶酶体用LysoTracker(绿色)染色。细胞核用Hoechst33342(蓝色)染色
键实现GSH响应性释药,Wan等设计了一种CaCO3矿化的NMOF结构递送系统实现双氢青蒿素(DHA)的程序性释放(NMOF@DHA@CaCO3),递送系统到达肿瘤部位后,利用GSH和Fe3+之间的氧化还原反应触发DHA的释放与TCPP的活化,进而实现Fe2+-DHA介导的化学动力学治疗(CDT)、TCPP介导的PDT(图5A)。由透射电镜图像显示,无GSH存在时,弱酸性pH仅使外部矿化层溶解,而NMOF的核心并无明显塌陷。当pH6.5伴随GSH存在时,NMOF在30min内产生部分降解(图5B~C)。铁定量分析结果表明在GSH存在时所释放Fe含量为不含GSH时释放量的10倍。最后,以4T1荷瘤小鼠为动物模型研究了NMOF@DHA@CaCO3在体内的抗肿瘤效率(图5D),结果证明该递送系统具有良好的生物相容性及增强的抗肿瘤效果,治疗后期肿瘤并无复发和转移现象,甚至可以完全消除肿瘤,这为未来体内氧化还原型响应释药系统的设计提供参考。
3.4酶响应
与正常细胞相比,肿瘤细胞的快速增殖及侵袭能力导致TME中某些酶的异常表达,常见的与肿瘤相关的酶包括基质金属蛋白酶(MMPs)、组织蛋白酶、成纤维细胞活化蛋白-α(FAP-α)、磷脂酶等。其中,组织蛋白酶B(CatB)和豆荚蛋白酶主要为溶酶体酶,也存在于肿瘤ECM。由于这些酶的高选择性和催化活性,以特定酶表达水平的改变作为响应性刺激源,设计具有酶响应性的纳米递药系统有利于降低全身毒性,增强抗肿瘤效果。例如,研究发现MMP-2在肿瘤细胞中的表达比正常组织高10~20倍,主要通过降解ECM促进肿瘤细胞的侵袭和转移。因此,Xu等以具有MMP-2敏感性的明胶作为聚合物材料,采用单相凝聚法合成一种明胶纳米颗粒(Ge-DOX-5-ALA/NPs),通过递送化疗药物DOX及光敏剂5-ALA实现肿瘤的协同治疗。该纳米颗粒的粒径均小于200nm,经MCF-7细胞内化后,高表达的MMP-2可降解明胶载体以促进DOX的快速释放。
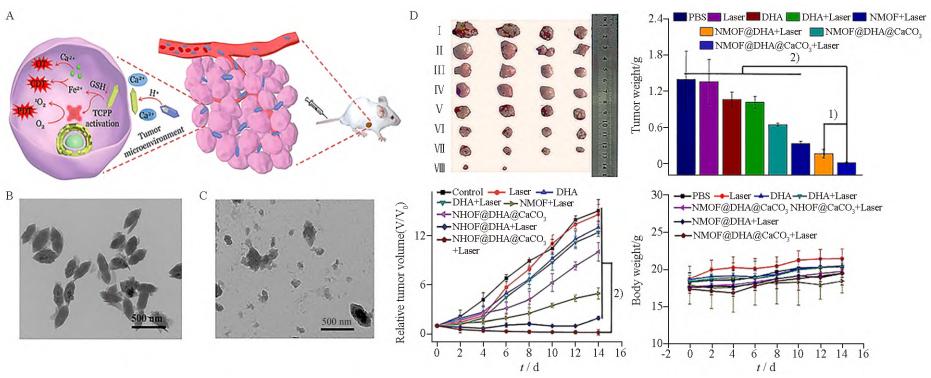
图5 纳米平台的制备、表征及体内抗肿瘤效果.n=4,x±s
(A)纳米平台的制备和程序性药物释放示意图;
(B)pH6.5,无谷胱甘肽(GSH)条件下NMOF@DHA@CaCO3形态;
(C)pH6.5,存在GSH条件下处理30min的NMOF@DHA@CaCO3形态;
(D)和纳米平台的体内抗肿瘤效果;检测值间有差异,1)P<0.01,2)P<0.001
与正常乳腺细胞Hs578Bst相比,36h时MCF-7细胞的累积释放率是Hs578Bst细胞的4倍。除了过表达的MMPs外,Cat-B的含量和活性均高于正常组织,并且肿瘤细胞分泌的Cat-B不能被溶酶体激活,只能以酶的形式存在于细胞质或细胞外部。因此,Du等制备了一种pH/Cat-B分级响应的纳米复合物HRNs,将PTX精准递送至肿瘤细胞内。PTX通过Cat-B响应的四肽与pH响应的聚合物相连,自组装形成直径为40nm的稳定纳米结构。该纳米复合物在血液循环中保持稳定,一旦到达肿瘤弱酸性环境则会分解形成5nm的共聚物,有助于肿瘤的深度扩散,经细胞内化后被溶酶体吞噬,Cat-B裂解四肽连接剂,释放药物到细胞质从而抑制肿瘤细胞增殖。该递送系统通过程序性响应实体肿瘤中细胞的内源性刺激来控制释药,为肿瘤的精准治疗提供了一种潜在的临床治疗方法。此外,豆荚蛋白酶是一种高度保守的半胱氨酸蛋白酶,广泛分布于溶酶体和细胞核,并在多种肿瘤细胞中表达上调。Li等为了实现抗肿瘤药物的特异性释放,利用PEG-b-PBLA聚合物、pH响应的OAPI聚合物、具有豆荚蛋白酶敏感性和荧光碳点的肽-DOX前药(CDs-C9-AANL-DOX)合成一种双响应的前药包埋纳米递送系统(DS-NA)。在MDA-MB-435S细胞中,利用弱酸性环境DS-NA快速分解释放出CDs-C9-AANL-DOX,过表达的豆荚蛋白酶促使AANL连接物断裂,释放DOX作用于细胞核。体外细胞毒性研究显示,DS-NA对MDA-MB-435S细胞的细胞毒性明显高于4T1细胞,其IC50值分别为4.841和16.098μg·mL-1。此外,实体肿瘤的乏氧特征可以刺激4T1细胞中豆荚蛋白酶的表达增加,已有报道证实在4T1乳腺癌荷瘤小鼠体内豆荚蛋白酶大量表达。因此,以4T1荷瘤小鼠为模型评价DS-NA的体内抑瘤性,结果显示与对照组相比,DS-NA的肿瘤抑制率高达94.3%,且对正常器官几乎无损伤,是一种切实可行的抗肿瘤药物递送系统。
4.调节TME的纳米递送系统
为了满足肿瘤细胞的过度增殖,实体肿瘤需要独立的血液供应,即肿瘤的新生血管生成。血管形成不仅为肿瘤生长提供了有利条件,异常的血管结构还会阻碍药物外渗和分布,无法得到理想的治疗效果。抗血管药物是一类具有肿瘤血管靶向性的治疗药物,主要包括抑制血管生成因子的抗血管生成药物(AAAs)和破坏肿瘤血管的血管破坏剂(VDAs)。因此,利用抗血管药物来调节肿瘤血管生成逐渐成为一种可行的治疗策略。在抗血管生成方面,索拉非尼(Sorafenib,SFN)作为一种酪氨酸激酶抑制剂,具有抑制肿瘤细胞增殖和抗血管生成作用。Clavreul等设计了一种封装SFN的脂质纳米胶囊(SFB-LNCs),通过立体定向注射使纳米粒子在颅内进行有效递送以对抗胶质母细胞瘤的生长。结果表明,SFN-LNCs能够有效诱导早期肿瘤血管正常化,包括肿瘤血流量增加,血管面积减少,具有良好的肿瘤抑制作用。此外,Wei等将光热治疗(PTT)、PDT及抗血管生成治疗结合,利用再沉淀法制备出装载SFN和光敏剂Ce6的多功能纳米粒子(SCNPs),该粒子在PDT和PTT中均具有ROS生成和光热转换能力,光疗杀死内部肿瘤细胞的同时抗血管生成药物能够切断肿瘤细胞的外部营养和氧气供给,进一步加速肿瘤细胞凋亡。HUVEC细胞管形成和抗血管生成研究显示,经SCNPs处理的细胞管中,血管的精细结构逐渐分解,且10h时几乎无血管结构,而对照组的血管则有自然生长的趋势,证明SCNPs能够通过抗血管生成作用有效破坏细胞管。除此之外,破坏肿瘤血管使血液供应减少导致肿瘤组织坏死是调节肿瘤血管的另一种方法,一些血管干扰剂可以诱导内皮细胞的凋亡和坏死,进而破坏已形成的肿瘤血管。例如Bao等将可生物降解的聚(L-谷氨酸)(PLG)分别与疏水光敏剂(TPP-NH2)、血管干扰剂(CA4)进行化学偶联得到聚合物-药物偶联物PT和PC。联合使用PT和PC时,PLG降解后释放的TPP-NH2主要通过产生1O2杀死边缘肿瘤细胞,而释放的CA4能够有效切断肿瘤血管导致肿瘤中心区域坏死。体外分析表明,血管靶向治疗与PDT的协同作用能够增强抗肿瘤疗效,为临床肿瘤治疗提供参考。
乏氧作为TME的主要特征之一,药物通常无法有效递送至肿瘤内部的缺氧区域,不仅促进了肿瘤转移,还增强了肿瘤对PDT、放射治疗(RT)等治疗方法的耐药性,因此,如何提高肿瘤内部的含氧量成为增强抗癌治疗的一个新方向。研究发现,通过原位反应间接供氧是缓解肿瘤缺氧的一种有效的方法。为此,Zhu等开发了具有PEG修饰的MnO2纳米粒子负载光敏剂Ce6(Ce6@MnO2-PEG),独特的MnO2纳米颗粒与内源性过氧化氢(H2O2)反应可持续产生O2,进而增强PDT疗效。由于O2是PDT过程中的必要条件,该课题组利用氧气探针测定了不同浓度的纳米颗粒在H2O2溶液中的O2生成量,结果显示,Ce6@MnO2-PEG能在H2O2溶液中快速生成O2,随纳米粒子的浓度增高,O2生成量也逐渐增加。细胞毒性实验表明,游离Ce6和纳米颗粒在O2环境中表现出相似的光毒性水平,而处于N2环境中的游离Ce6与Ce6@MnO2-PEG相比,纳米粒子对4T1细胞的毒性明显高于游离组,由此可见Ce6@MnO2-PEG即使在缺氧环境中也能杀灭肿瘤细胞,是一种切实可行的乏氧调节策略。除乏氧特征外,TEM中的弱酸性环境同样会导致治疗失败。为了调节TME的弱酸性pH,Li等设计了一种用于联合光热/光动力/饥饿疗法的多功能纳米放大器(MPDA@MnO2-MBGOx),介孔聚多巴胺(MPDA)表面的MnO2纳米片可与内源性H2O2反应产生O2来缓解肿瘤缺氧,在葡萄糖氧化酶(GOx)的催化下消耗葡萄糖以提高TME的酸度和细胞内H2O2的浓度,进一步促进MnO2纳米片产生O2,这种高效的级联反应使该纳米系统的功效最大化。体内外研究表明,具有自增强酸度和缺氧缓解功能的MPDA@MnO2-MB-GOx表现出明显的肿瘤抑制能力。
5.总结和展望
纳米递送系统为抗肿瘤药物的治疗带来了许多潜在的好处,并已在临床中使用。基于TME设计的智能纳米递送系统能够实现药物精准递送和可控释放,为提高抗肿瘤药物的传递效率和治疗效果带了机遇。尽管对肿瘤微环境已研究多年,但设计利用TME的纳米递送系统仍处于起步阶段,如何进一步克服TME中复杂的生物屏障依然是药物递送中的一项挑战,例如EPR依赖于肿瘤血管化和血管生成的程度,纳米颗粒在不同肿瘤中积累具有异质性,多数纳米递送系统仍具有较差的实体肿瘤递送效率;虽然主动靶向作用能进一步改善肿瘤积累,但是当递送系统与血液相互作用时,血浆蛋白可能会吸附在纳米粒子表面形成蛋白冠,进而减少甚至消除配体与相应受体的特异性识别能力,对纳米递送系统的主动靶向性和细胞摄取能力均有影响。此外,如何降低血液循环过程中的清除率仍然是有效利用纳米递送系统的最重要问题之一,目前最常见的方法是在递送系统包覆PEG层,以减少网状内皮系统(RES)的识别和清除,但PEG涂层同样抑制了纳米粒子与细胞之间的相互作用。因此,为了达到最佳的抗肿瘤药物递送效率,设计具有2个或2个以上靶向配体的多重靶向递送系统或刺激响应的靶向递送系统是一种有前景的解决策略。
由于恶性肿瘤是一种复杂的疾病,仅利用TME的某一特征所设计的纳米递送系统可能无法达到最佳递送效果,例如实体瘤含有高浓度GSH,然而GSH分布于全身,纳米粒子通过静脉注射后在血液中循环的时间较长,如何避免血液中少量GSH导致药物过早释放也是十分有必要的。为了进一步控制药物的精准释放,将多维治疗模式结合所设计的递送策略具有明显的优势,例如一种递送系统可以同时调节肿瘤的pH值和提高氧浓度,或是将pH敏感释药和双重主动靶向系统结合,亦或是输送过程中随着环境动态调节尺寸的多功能递送系统,以改善肿瘤穿透能力。因此,开发利用独特的肿瘤特性的智能递送系统可以在肿瘤纳米治疗方面取得重大进展。
发展纳米递送系统的最终目标是临床转化。尽管已经开发了许多小鼠模型来研究人类肿瘤,但是人类肿瘤在许多方面不同于小鼠,例如肿瘤基质细胞、代谢率和药物动力学等,使用异种移植肿瘤模型来测试药物反应通常不能再现患者的临床现实。尽管有这些缺点,异种移植模型仍然是提高对恶性肿瘤认识和治疗的有力工具。进一步了解人类肿瘤的微环境对于纳米医学应用于临床至关重要。总之,基于肿瘤微环境设计纳米递药系统为肿瘤治疗提供了新思路,有助于增强治疗效果。
参考文献:《基于肿瘤微环境增强抗肿瘤治疗效果的纳米递药系统设计及应用》

