针对巨噬细胞的凋亡细胞模拟脂质体的最佳开发
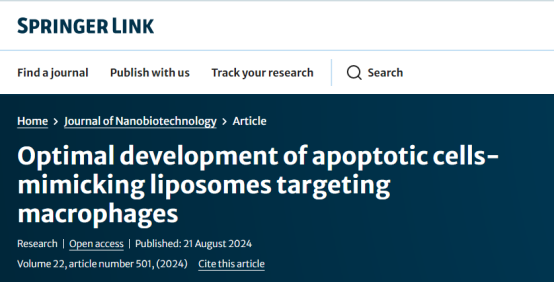
巨噬细胞是多功能先天免疫细胞,在体内平衡、组织修复和免疫调节中发挥着不可或缺的作用。然而,巨噬细胞的失调激活与各种人类疾病的发病机制有关,使其成为治疗的潜在靶点。通过表达模式识别和清道夫受体,巨噬细胞表现出对病原体和凋亡细胞的选择性摄取。因此,利用模拟致病或凋亡信号的药物载体显示出向巨噬细胞定向递送的潜力。在这项研究中,通过实验设计(DoE)策略和反复试验(TaE)方法开发了一系列甘露糖化或/和磷脂酰丝氨酸(PS)呈递脂质体以靶向巨噬细胞。通过体外细胞摄取实验和对RAW264.7和THP-1的细胞毒性评价结果确定脂质体最佳配比为DOPC:DSPS:Chol:PEG-PE=20:60:20:2。体内分布实验结果表明,在DSS诱发的结肠炎模型和胶原Ⅱ诱发的类风湿关节炎模型中,PS呈递脂质体(PS-Lipo)在肠道和足爪的蓄积量最高,巨噬细胞在炎症部位丰富,参与相应疾病的进展,对巨噬细胞靶向治疗具有良好的应用前景。心脏、肝脏、脾脏、肺脏和肾脏等器官在暴露于PC呈递脂质体(PC-Lipo)或PS-Lipo时未出现炎症或坏死等组织学改变。此外,脂质体具有良好的血液生物相容性,对循环系统无肝肾毒性,不会诱发动物代谢损伤,设计良好的PS-Lipo在巨噬细胞靶向治疗方面具有最大的潜力。
在本研究中,开发了甘露糖化或/和PS脂质呈递脂质体以靶向巨噬细胞(图1A)。采用实验设计(DoE)策略和反复试验(TaE)方法来通过考虑尺寸、表面电荷、巨噬细胞靶向效率和最小化细胞毒性来确定最佳脂质体制剂。从体外筛选到体内验证的转变代表了靶向治疗脂质体制剂开发的关键阶段。因此,在体外筛选过程以确定最佳脂质体制剂之后,使用三种完善的小鼠炎症模型来验证优化脂质体制剂在炎症部位的靶向特异性,在这些部位巨噬细胞丰富并有助于相应疾病的进展,通过体内生物分布成像(图1B)。此外,还评估了制备的脂质体的体内生物相容性。预计这项研究获得的见解将对制定针对各种巨噬细胞相关疾病的针对性治疗策略做出重大贡献。
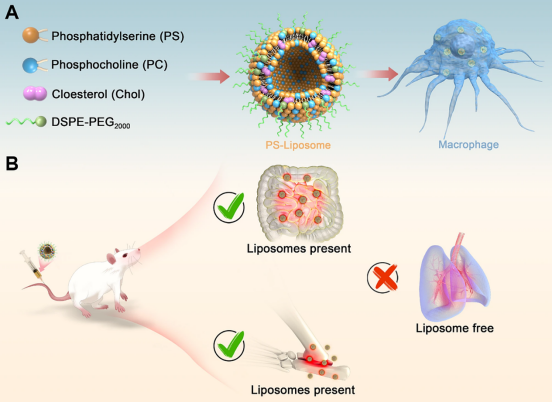
图1(A)PS呈递脂质体的配方和靶向递送至巨噬细胞的示意图。
(B)在三种小鼠炎症模型中对PS呈递脂质体的靶向能力进行体内验证
DoE策略优化脂质体中单个脂质的比例
首先,通过改变DPPS、1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(DSPC)、胆固醇(Chol)和Man-PEG-DSPE等成分的摩尔比,采用DoE策略生成了一系列具有17种配方的脂质体(图2A和B)。脂质体高度均匀,粒径在80至100nm之间,多分散指数(PDI)始终低于0.2(图2C)。随着DPPS比例的增加,zeta电位降低,而PEG含量的增加导致配方接近中性zeta电位(图2D)。细胞摄取实验表明,DPPS含量与巨噬细胞靶向功效之间存在正相关性,表明DPPS在增强细胞相互作用方面具有潜在作用(图2E和G)。随着PEG含量的增加,细胞摄取量下降,提示需要平衡的PEG浓度以保持靶向特异性和细胞内化(图2E)。细胞毒性测定结果表明,在大多数情况下,胆固醇含量低于20%会引起相当大的毒性,而DPPS超过30%和胆固醇与DSPC结合低于40%的制剂也会增加细胞毒性。同时,DPPS含量超过60%也会增加细胞毒性(图2F)。基于以上结果,进一步制定了优化指导原则,规定摩尔组成为胆固醇含量(20−50%)、DSPC≥20%、DPPS≤60%,Man-PEG-DSPE的摩尔比例固定为总脂质含量的2%,其中包括胆固醇、DSPC和DPPS。
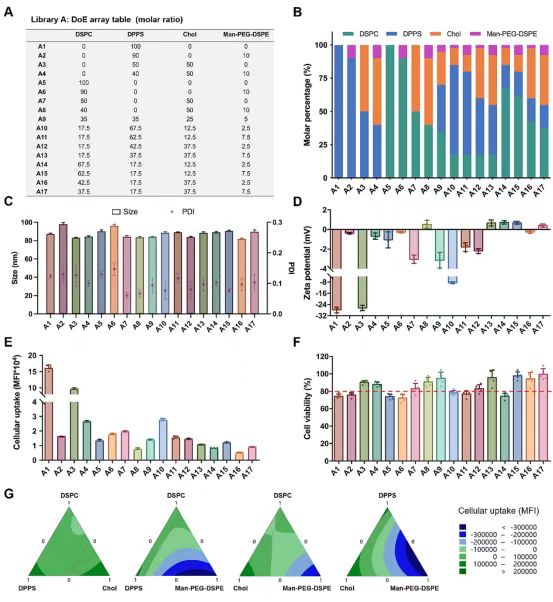
图2 DoE策略用于优化库A中的脂质体组成比
TaE方法微调脂质体的脂质组成
结合DoE策略,TaE方法用于根据经验观察对脂质体配方进行微调。通过反复调整来优化脂质体特性,确保复制对有效靶向巨噬细胞至关重要的凋亡细胞特征。这种实用方法补充了系统的DoE策略,可以灵活应对不可预见的挑战并提高成功开发配方的可能性。
磷脂结构变化(特别是脂肪酸链长和饱和度的差异)对PS呈递脂质体在巨噬细胞相互作用中的靶向效率和毒性的影响是我们研究的一个关键方面。已知磷脂中脂肪酸链的长度会影响膜流动性和脂质包装。同时,脂肪酸链的饱和度在塑造脂质体特性方面也起着关键作用。此外,磷脂酰甘油(PG)是革兰氏阴性细菌细胞膜的关键成分,具有可能影响其与巨噬细胞相互作用的独特特性。与PG相关的负电荷可能有助于提高巨噬细胞的识别和摄取,这与在细菌-宿主细胞相互作用中观察到的静电相互作用相似。PG的这种独特性质可能为定制脂质体制剂以模拟革兰氏阴性细菌的特性以进行靶向药物递送开辟新的可能性。因此,通过TaE方法研究了不同脂肪酸链长和饱和度的PS和PG结构修饰对巨噬细胞靶向性和细胞毒性的影响。选择了三种不同的PS结构,即DPPS、1,2-二油酰-sn-甘油-3-磷酸-L-丝氨酸(DOPS)和1,2-二硬脂酰-sn-甘油-3-磷酸-L-丝氨酸(DSPS),以及三种PG结构-1,2-二棕榈酰-sn-甘油-3-磷酸甘油(DPPG)、1,2-二油酰-sn-甘油-3-磷酸甘油(DOPG)和1,2-二硬脂酰-sn-甘油-3-磷酸甘油(DSPG)-根据它们的可比脂肪酸链长和饱和度进行选择。
采用TaE方法制备了六种固定比例的脂质体。平均粒径为90nm,PDI<0.2(图3A)。脂肪酸链长越长、饱和度越高,负电位越大(图3B)。在细胞摄取实验中,结果表明,用DSPS和DOPG修饰的脂质体在巨噬细胞摄取中的效率最高(图3C),这表明DSPS和DOPG的特定结构特征有助于增强巨噬细胞的识别和内化,表明它们有可能成为靶向药物递送系统的有希望的候选者。然而,值得注意的是,尽管用DOPG修饰的脂质体具有很高的靶向效率,但它们表现出更高的细胞毒性(图3D)。这一观察结果强调了仔细考虑修饰脂质体的靶向功效和安全性的重要性。平衡这些因素对于制定有效的治疗策略以最大限度地减少潜在的副作用至关重要。因此,选择DSPS替代DPPS进行进一步研究。此外,我们还评估了三种具有不同脂肪酸链长和磷脂饱和度的PC结构磷脂。
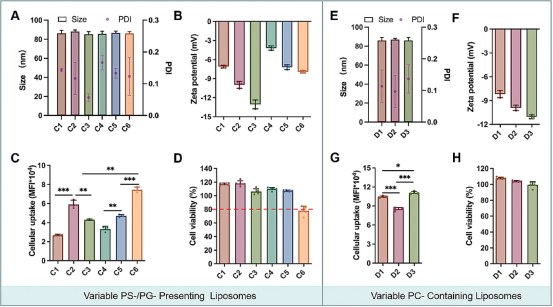
图3TaE方法用于微调脂质体的脂质组成
进一步,研究人员设计了一系列脂质体来验证PS结构、PEG含量和Man修饰对巨噬细胞靶点的影响。如图4A和B所示,制备了均匀的脂质体,平均粒径为90nm,PDI<0.2。较低的zeta电位对应于脂质体中DSPS比例的增加,并且与较高的PEG接近中和。在2%PEG组中,Man修饰对细胞摄取没有影响,而细胞摄取随着Man修饰而增加。PS组的细胞摄取显著高于PC组,然而,高达60%的PEG抵消了PS的影响(图4C)。通过共聚焦激光扫描显微镜(CLSM)观察到RAW264.7和THP-1对Lipo-E6的最显著细胞摄取(图4D)。积累的数据启发我们,PS修饰可以改善巨噬细胞靶向性,而Man修饰对巨噬细胞靶向性没有明显影响,这可能是由于CD206表达的差异所致。因此,将使用PEG-PE组成的脂质体进行进一步研究(最终配方DOPC:DSPS:Chol:PEG-PE=20:60:20:2,摩尔比),平均粒径为86.1nm,zeta电位为-11.16mV(图4E-H)。有趣的是,上述结果表明,随着PS修饰的增加,zeta电位降低,而脂质体的细胞摄取增加。尽管PS修饰降低了脂质体的正电荷,但由于PS对巨噬细胞具有强靶向亲和力,因此增强了脂质体的特异性和巨噬细胞的摄取。这种靶向相互作用对于需要精确递送至巨噬细胞的应用至关重要。
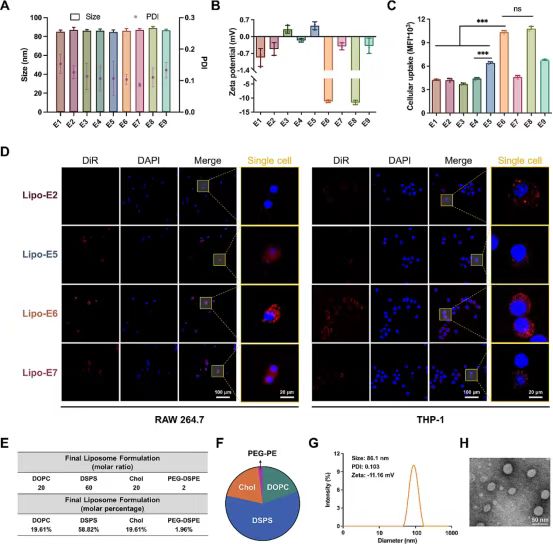
图4(A)库E(n =3)中制备的脂质体的粒度、PDI和(B)Zeta电位。
(C)库E中不同脂质体配方在RAW264.7细胞(n =3)上的细胞摄取的流式细胞术分析。
(D)与RAW264.7和THP-1细胞孵育1小时后,不同DiD负载脂质体的细胞内化的共聚焦显微镜图像。
细胞核经Hoechst(蓝色)染色。比例尺为100μm和20μm。(E)DoE和TaE筛选后确定的脂质体配方。
(F)优化脂质体配方的摩尔百分比。
(G)优化后的脂质体摩尔比为20:60:20:2(DOPC/DSPS/Chol/PEG-DSPE)的表征总结
(H)优化后的脂质体经磷钨酸溶液染色后的TEM图像(比例尺:50nm)。
数据以平均值±SD表示,***p <0.001;ns,不显著
评估已鉴定脂质体在小鼠炎症模型中靶向巨噬细胞的潜力
首先,在健康BALB/c小鼠尾静脉注射游离DiR染料、PC-Lipo/DiR和PS-Lipo/DiR后,研究PC-Lipo和PS-Lipo在体内的分布情况。24小时后,对小鼠实施安乐死,并解剖主要器官进行荧光成像。PC-Lipo/DiR组的荧光信号在除肺以外的所有器官中最高。有趣的是,在肺部,PC-Lipo/DiR和PS-Lipo/DiR组均表现出相对较低的荧光信号。难以实现实质性的肺部分布可能归因于复杂的肺部微环境。肺部环境对脂质体的积累提出了独特的挑战,肺部的快速血流和低血管通透性可能是导致观察到的积累减少的原因。此外,在其他组织中观察到的荧光表明非肺部器官可能具有潜在偏好,这可能会影响这些脂质体制剂的整体生物分布。此外,PC-Lipo/DiR和PS-Lipo/DiR的大部分积累是在巨噬细胞聚集的肝脏和脾脏中观察到的。
然后,建立了三种小鼠炎症模型,并用于研究游离DiR染料、PC-Lipo/DiR和PS-Lipo/DiR的体内生物分布。之所以选择这些模型,是因为在炎症部位巨噬细胞富集。在DSS诱导的结肠炎模型中(图5A),与对照组相比,在肠道中观察到脂质体的显著积累(图5C和D)。苏木精和伊红(H&E)染色图像显示肠道发炎和坏死,表明结肠炎模型成功(图5B)。此外,免疫组织化学(IHC)和流式细胞术实验均表明发炎肠道中巨噬细胞浸润显著增加。这些结果支持脂质体可以被巨噬细胞招募到发炎区域的潜力。我们进一步改变了胶原蛋白II诱导的RA模型中的巨噬细胞靶向性(图5E)。H&E图像显示滑膜发炎,番红O/固绿染色显示软骨退化(图5F),共同验证了RA模型的成功。还观察到巨噬细胞水平增加。与PC-Lipo/DiR相比,PS-Lipo/DiR在小鼠爪中表现出更高的荧光信号(图5G和H)。虽然PS-Lipo/DiR在炎症部位表现出更高的积累,但其在其他主要器官中的分布与健康小鼠中观察到的相似。这些结果证明了PS-Lipo出色的炎症靶向特异性。这一观察结果与PS对巨噬细胞的已知亲和力相符,证实了PS修饰可以增强脂质体向炎症部位的靶向递送。在最近的一项研究中,DeprezJ等人发现,选择性消耗循环髓系细胞可使脂质体的积累减少高达50%至60%,这表明髓系细胞介导的运输占炎症区域中脂质体积累的一半以上。这项研究表明,PS呈递脂质体很可能与血液中的大量免疫细胞结合,包括巨噬细胞前体单核细胞。理论上,任何能够识别和吞噬PS信号的免疫细胞都有可能与PS呈递脂质体结合。在炎症反应期间,越来越多的免疫细胞(包括巨噬细胞及其前体)被募集到炎症部位。PS呈递脂质体旨在靶向巨噬细胞或其他PS识别免疫细胞,由于免疫细胞的存在增加,能够被动靶向炎症区域,从而确保脂质体有效地导向最需要它们的部位。
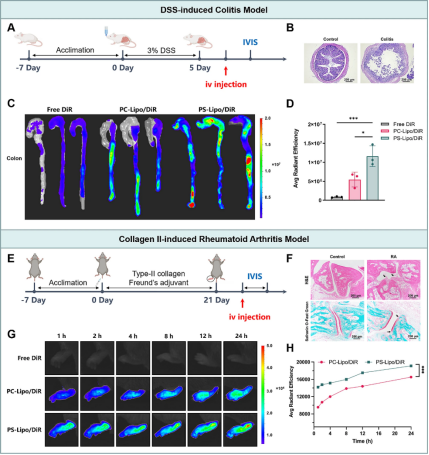
图5体内小鼠炎症模型评估PS呈递脂质体对巨噬细胞的靶向性
然而在脂多糖(LPS)诱导的肺部炎症模型中却出现了明显的差异,PC-Lipo和PS-Lipo都未能到达肺组织,这与健康小鼠的观察结果一致。两组肺部荧光水平相当甚至更低表明,与PC-Lipo相比,PS改性不会加剧或减轻肺部输送的挑战。PS-Lipo无法到达肺部可能归因于不同组织不同的病理生理环境,或者更广为接受的观点是蛋白质冠的形成影响了它们在体内的分布。蛋白质冠的形成显着改变了纳米颗粒的表面特性,从而极大地影响了它们与器官和细胞的相互作用。在最近的一项研究中,LeND等人。合成了一系列聚β-氨基酯(PBAE)衍生物,发现纳米粒子上的蛋白质冠有助于实现器官靶向(肺和脾脏)。有趣的是,他们的发现与MinQiu等人的研究密切相关,后者证明肺靶向纳米粒子上的蛋白质冠具有促进肺部蓄积的独特特性。脂质体表面形成的蛋白质冠主要受脂质体本身的物理化学性质的影响。通过选择不同的脂质成分或改变它们的比例,可以实现对不同器官或细胞的靶向。2020年,DanielSiegwart等人报道了一种选择性器官靶向(SORT)递送技术。他们将阳离子脂质DOTAP作为第五种成分引入到配方5A2-SC8/DOPE/DMG-PEG2000/Cholesterol中,从而改变了LNP的物理化学性质,包括其zeta电位。这种改变影响了血液循环过程中蛋白质冠的形成,从而能够通过静脉将mRNA递送到肺部。最近,DanielSiegwart团队报告了使用LungSORTLNP递送ABEmRNA/sgRNA对肺干细胞进行基因编辑,治疗肺囊性纤维化。这些发现凸显了操纵纳米颗粒特性及其蛋白质冠以实现向特定器官(包括肺部)的靶向递送的复杂性和潜力。因此,一种有希望的途径是将阳离子脂质引入脂质体配方中,这可能会引入更平衡的表面电荷,从而实现肺靶向。然而,确切的机制和最佳策略需要进一步研究,以增强肺靶向脂质体递送系统的功效。
此外,还进行了药代动力学实验,以研究PC-Lipo和PS-Lipo在小鼠体内的药代动力学特征。如图6C所示,与PC-Lipo相比,PS-Lipo表现出更快的代谢率。具体而言,50%的PS-Lipo在注射后2小时内代谢,近80%在24小时内从体内清除。PS-Lipo的快速清除可归因于身体清除机制增强的识别和清除,这可能是由于PS修饰模仿了凋亡信号。这促进了免疫细胞的识别和吞噬作用,从而更快地从体内消除。因此,PS-Lipo的快速代谢不仅强调了其有效清除,而且还意味着潜在的更低的全身暴露和毒性,从而提高了其在体内应用的安全性。相比之下,PC-Lipo表现出较慢的代谢率,导致体内循环时间延长。PC-Lipo在血液中的长期存在可能导致其在肝脏和脾脏中大量积累,从而导致这些器官的吸收和积累程度高于PS-Lipo。
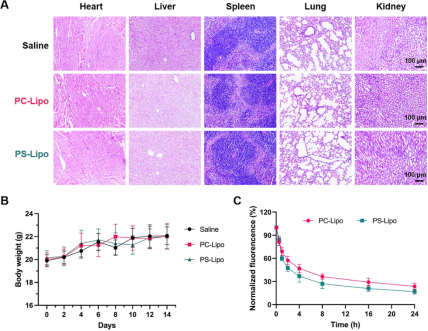
图6评估脂质体在健康BALB/c小鼠体内的生物相容性和药代动力学
结论
总之,本研究采用DoE策略和TaE方法相结合的方式筛选PS呈递脂质体的最佳配方,旨在有效靶向巨噬细胞,同时确保低细胞毒性。在三种小鼠炎症模型中进行了体内验证,以确认脂质体的巨噬细胞靶向能力。虽然脂质体在结肠炎和RA模型中表现出出色的巨噬细胞靶向性,但它们在肺部炎症模型中的靶向能力受到阻碍,表明需要进一步优化以靶向肺部炎症。对脂质体生物相容性的体内评估产生了有希望的结果,表明具有临床转化的潜力。总体而言,本研究强调了针对特定炎症条件优化脂质体配方的重要性,并强调了PS呈递脂质体作为靶向药物递送系统的潜在临床效用。确定的每种成分的最佳范围为合理设计针对巨噬细胞靶向的脂质体提供了宝贵的见解,有望在未来应用于药物递送和治疗干预。
原文链接:https://link.springer.com/article/10.1186/s12951-024-02755-3

