通过源自辐照癌细胞的生物功能化脂质体样纳米囊泡诱导治疗性免疫和消除癌症

免疫疗法彻底改变了癌症的治疗方法。然而,其疗效仍有待优化。通过免疫疗法有效消灭癌细胞至少面临两大挑战。首先,癌细胞通过下调细胞表面免疫传感器来逃避免疫细胞杀伤。其次,免疫细胞功能障碍会削弱其执行抗癌功能的能力。放射疗法是癌症治疗的基石之一,它有可能增强癌细胞的免疫原性并引发抗肿瘤免疫反应。受此启发,我们通过将辐照后的癌细胞暴露于乙醇中来制造生物功能化的脂质体样纳米囊泡(BLN),其中乙醇充当表面活性剂,诱导癌细胞焦亡样细胞死亡并促进纳米囊泡从癌细胞膜上脱落。这些BLN经过精心设计,可破坏上述两种机制。一方面,BLN上调癌细胞表面“吃我”信号钙网蛋白的表达,从而促进巨噬细胞吞噬癌细胞。此外,BLN能够将M2样巨噬细胞重编程为抗癌M1样表型。使用恶性胸腔积液(MPE)小鼠模型(一种晚期和免疫疗法耐药的癌症模型),我们证明BLN显著增加T细胞浸润并对MPE表现出消融作用。当与PD-1抑制剂(α-PD-1)结合时,我们在患有MPE的小鼠中实现了显著的63.6%(11只中有7只)的治愈率,同时还诱导了免疫记忆效应。因此,这项工作引入了一种克服免疫疗法耐药性的独特策略。
BLN的合理设计、制备和表征
为了最大限度地提高BLN的产量,我们通过外部干扰刺激微粒释放。乙醇能够增强肝细胞外囊泡的形成,这启发了我们研究在不同乙醇浓度下稳定转染红色荧光蛋白(LLC-RFP)的Lewis肺癌细胞中的微粒形成情况。不同的乙醇浓度会引起不同的细胞反应,低浓度无法有效释放囊泡,而高浓度会导致细胞过早崩解和囊泡生成受限。然而,我们发现30%的乙醇刺激可以确保最佳囊泡生成,其方式类似于ShaoFeng等人研究中描述的细胞焦亡,而不会导致处理后的细胞单纯增大或突然破裂(图1A)。为了验证30%乙醇处理后肿瘤细胞是否发生焦亡,我们检测了LLC中高表达的经典焦亡标志物的裂解情况。Westernblot显示30%乙醇刺激不影响GSDMD和GSDME的裂解,即30%乙醇处理仅诱导了类似于焦亡的形态学变化,称为焦亡样细胞死亡。考虑到酒精可能影响BLNs膜上蛋白质的功能,我们探讨了30%酒精对膜蛋白功能的影响,并选择钙网蛋白(CRT)作为代表进行研究。我们发现30%酒精并没有减弱CRT对巨噬细胞活化的作用。
我们之前观察到高剂量辐射(20Gy)可触发癌细胞释放杀肿瘤的RT-MPs。因此,我们用30%乙醇制备辐照过的癌细胞,并通过梯度离心从上清液中提取BLN(图1B)。透射电子显微镜(TEM)显示这些颗粒具有球形结构,表面略有起伏,直径在500到700nm之间(图1C)。随后,我们使用Malvern粒度仪测量了自发产生的MPs(N-MPs)、仅用30%乙醇刺激的MPs(E@MPs)、RT-MPs和BLN的大小。这些颗粒的平均尺寸分别为342、531、681.5和615nm(图1D)。流式纳米分析仪证实了BLN囊泡浓度较高。已知细胞外囊泡(EV)含有多种生物活性分子。为了探索BLN的蛋白质含量,蛋白质组学分析表明,在BLN中检测到的90%的蛋白质与亲本癌细胞中的蛋白质重叠(图1E)。除了典型的EV相关蛋白,如NA、K-ATPaseα1、CD9和肿瘤易感基因101蛋白(TSG101),我们的蛋白质印迹证实了代表性细胞骨架蛋白(β-肌动蛋白)、核蛋白(组蛋白H3)和线粒体相关蛋白的存在,包括HSP60、TOM20和TIMM23(图1F)。我们选取了BLN中富集程度最高的100个蛋白,与亲本癌细胞(LLC细胞系)相比,进行了KEGG富集分析,结果显示BLN中的蛋白可能参与了一系列细胞活动,尤其是激活先天免疫的途径(图1G)。这些结果表明,我们成功合成了一种新型的肿瘤细胞衍生微粒BLN,这种微粒富含生物活性分子,值得在肿瘤治疗领域进一步研究。
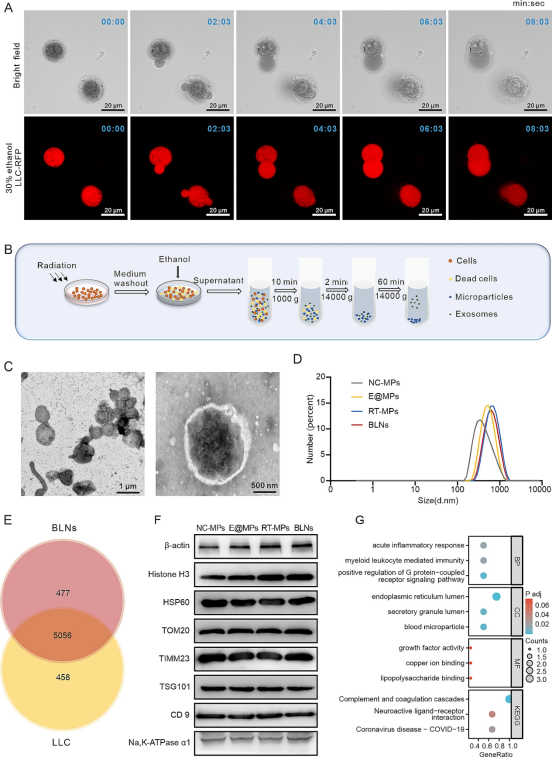
图1BLN的合理设计、制备和特性
BLN在激发抗肿瘤免疫力的同时,发挥出良好的MPE治疗潜力
为了测试BLN作为治疗癌症的治疗剂的潜力,我们使用了MPE小鼠模型,这是一种晚期且对免疫疗法有抵抗力的癌症模型,这种癌症通常对多种治疗有抵抗力。从癌症接种后第8天开始,我们每隔一天注射三剂BLN(图2A)。值得注意的是,BLN治疗可提高MPE小鼠的存活率(图2B)。为了进一步阐明BLN对体内TME的影响,我们收集了癌结节通过ELISA进行细胞因子分析,并收集了胸腔积液细胞进行流式细胞术分析。ELISA测试显示癌结节中的IFN-γ和IL-2水平升高,表明抗肿瘤免疫已被激活。与之相对应,胸膜癌结节的流式细胞分析和免疫组化染色均显示CD86+亚群增加,CD206+亚群减少(图2C、D),CD8+和CD4+亚群中IFN-γ+或GrzB+T细胞比例也同时增加,提示有杀伤性T细胞浸润(图2E-H、L)。虽然CD4+T细胞中Foxp3+亚群无明显差异(图2I),但Treg(Foxp3+CD4+)/Th1(IFN-γ+CD4+)比值降低(图2J),提示TME内的免疫抑制力量有所减弱。此外,我们还比较了BLN与E@MP和RT-MP的疗效。生存分析和体内成像显示BLN是最有效的治疗方法,具有最高的生存率(图2M、N)。这些发现表明BLN是一种有前途的MPE治疗剂,并具有调节抗肿瘤免疫的潜力
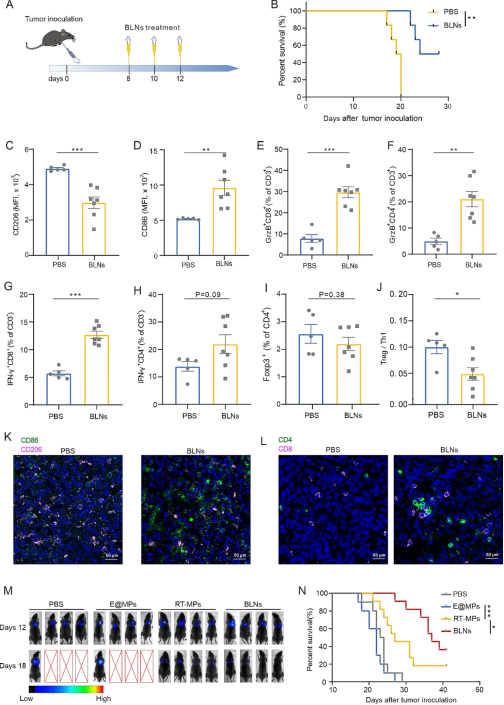
图2BLNs在激发抗肿瘤免疫力的同时,发挥着良好的MPE治疗潜力
BLN引发癌细胞的免疫原性死亡
为了阐明BLN治疗效果背后的机制,我们首先研究了BLN对癌细胞的影响。鉴于BLN会引起强烈的免疫反应,我们假设BLN介导的癌细胞死亡会产生免疫原性TME。因此,我们研究了BLN治疗后LLC中某些损伤相关分子模式(DAMP)的表达。结果表明,BLN治疗的癌细胞中三磷酸腺苷(ATP)和高迁移率族蛋白1(HMGB1)的释放以及细胞外钙网蛋白(CRT)的表达水平明显高于对照组(图3A-D)。当我们从RT-MP中优化BLN时,与其他类型的膜颗粒(包括RT-MP和E@MP)相比,它显著增加了DAMP的表达。我们进一步检查了囊泡处理后肿瘤细胞内的ROS水平和所示囊泡上的CRT表达,以阐明它们在诱导氧化应激和激活肿瘤免疫微环境中的差异。虽然与RT-MP相比,BLN在LLC中诱导的ROS增加相似,但BLN表面的CRT表达超过RT-MP,这意味着调节TME的能力更强。为了进一步探索BLN诱导细胞死亡的因素,利用GSH和所示细胞死亡抑制剂来确定BLN诱导细胞死亡的方式。结果表明,铁死亡是BLN诱导细胞死亡的主要方式,尽管细胞凋亡也会在较小程度上发生(图3E)。
癌细胞的免疫原性细胞死亡释放“找到我”和“吃掉我”的信号,进而促进吞噬性免疫细胞的募集和癌细胞的清除。因此,我们研究了骨髓来源的巨噬细胞(BMDM)对BLN处理的LLC细胞的吞噬作用。正如预期的那样,共聚焦图像和流式细胞术显示,BMDM更有可能吞噬BLN处理的癌细胞,与用RT-MP处理的LLC相比,吞噬率增加了1.2倍。此外,TAM也不可避免地受到BLN的影响,因此我们直接测试了用BLN处理的BMDM的吞噬能力,发现它们更善于吞噬LLC细胞(图3F-H)。总之,BLN诱导肿瘤细胞的免疫原性死亡,并促进TME中的清除剂将其消灭。
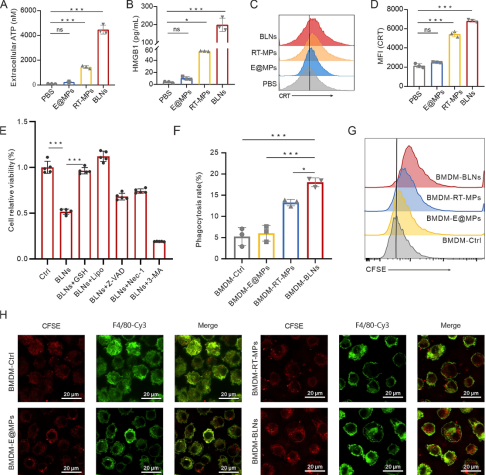
图3BLN引发肿瘤细胞的免疫原性死亡。
BLN通过激活MAPK信号通路重新编程TAM
首先,我们检查了巨噬细胞对PKH26标记的BLN的摄取。共聚焦图像和流式细胞术显示,BLN在12小时内逐渐被巨噬细胞吸收(图4A-C)。用BLN处理的IL-4诱导的BMDM-M2细胞的RNA-seq分析显示与M1极化相关的基因(Nos2、Il1a、Il1b、Il12a)显著上调,这通过实时定量PCR(RT-qPCR)进一步验证(图4D、E)。经BLN处理的M2巨噬细胞上清液Elisa检测也发现IL-1α和IL-12分泌增加,TGF-β产生减少。Western印迹进一步验证了iNOS上调和IRF4下调(图S4B)。GSEA富集分析显示,MAPK6/MAPK4信号通路是BLN处理后最显著富集的通路之一(图4F),这对M1极化至关重要。随后的Western印迹分析也证实了BLN刺激后p38、ERK和Stat1的磷酸化水平增加,表明MAPK信号激活及其下游的转录调控(图4G)。与其他膜颗粒相比,BLN在BMDM上上调CD86表达和下调CD206表达方面始终最有效,证实巨噬细胞向M1表型极化(图4H-K)。为了排除BMDM诱导方法可能造成的偏差,我们进一步比较了IL-4单独或IL-10与IL-4组合诱导BMDM向M2表型转化的效果。结果发现,两种方法均可有效诱导M2巨噬细胞,BLN可将其重新编程为M1表型。由于我们观察到指示囊泡使M2巨噬细胞重新极化的能力不同,我们接下来将探索背后的机制。注意到与放射治疗相关的囊泡(BLN、RT-MP)具有比未接受放射治疗的囊泡(N-MP和E@MP)更高的组蛋白含量(图1F),这表明与放射治疗相关的囊泡携带的dsDNA成分可能发挥一定作用。为了验证这一假设,我们去除了BLN、RT-MP和E@MP中的dsDNA,发现去除dsDNA会降低RT-MP和BLN的重编程能力。总之,我们的研究结果表明,TAM吞噬BLN,随后在MAPK信号激活后向M1表型极化。

图4BLN通过激活MAPK信号通路重新编程肿瘤相关巨噬细胞
BLNs与α-PD-1的结合显著激活抗肿瘤免疫力
BLNs可激活杀伤肿瘤免疫并促进抗肿瘤免疫细胞浸润。然而,PD-1等免疫检查点是T细胞介导的癌细胞杀伤的主要障碍。因此,我们测试了BLNs与α-PD-1结合调节TME的能力。在联合治疗下,MPE小鼠胸腔灌注液中免疫细胞的比例和功能发生了很大变化。流式细胞术分析显示,联合治疗导致CD3+T细胞的浸润比其他组更多(图5A、B)。此外,在CD3+T细胞中,CD8+T细胞的百分比增加,CD4+T细胞的百分比降低。联合治疗下CD8+GrzB+T细胞、CD8+IFNγ+T细胞和CD4+IFNγ+T细胞的增加表明T细胞介导的肿瘤毒性被激活(图5C-H)。与此同时,Treg(Foxp3+CD4+T细胞)水平无明显变化。这些结果表明BLN与α-PD-1联合使用可以促进抗肿瘤T细胞的浸润和功能。
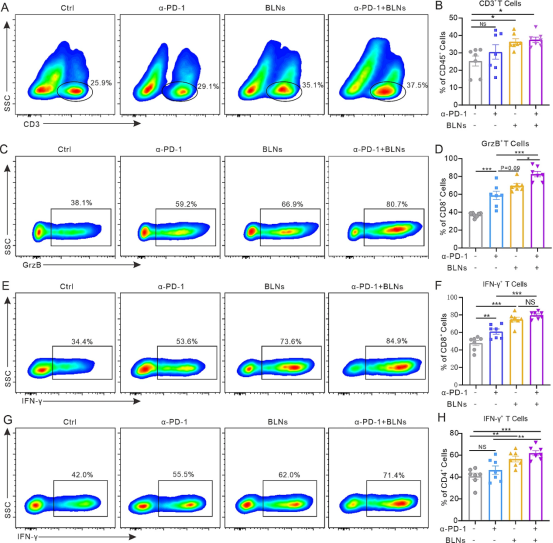
图5BLN和PD-1阻断的组合可显著激活抗肿瘤免疫力
CD8+T细胞和巨噬细胞主导联合治疗疗效
从肿瘤接种后第8天开始,每隔一天给予3剂BLN联合α-PD-1(图6A)。体内成像显示联合疗法有效延缓了MPE的进展(图6B)。在接种LLC或B16-F10的小鼠中,与单独使用BLN或α-PD-1相比,BLN和α-PD-1的组合在提高生存率方面表现出更高的功效。生存率可能高达63.6%(图6C)。然后,我们研究了巨噬细胞、CD4+T细胞和CD8+T细胞在MPE联合治疗中的作用。这是通过分别使用氯膦酸盐脂质体(图6D)、抗CD4抗体和抗CD8抗体有效消耗巨噬细胞、CD4+T细胞和CD8+T细胞来实现的。CD8+T细胞的消耗显著削弱了联合疗法的治疗效果(图6E),随后巨噬细胞被清除(图6F)。然而,CD4+T细胞的清除效果可忽略不计(图6G)。这表明CD8+T细胞占主导地位,巨噬细胞在联合治疗方案中起辅助作用。总之,这些发现表明,将BLN与α-PD-1疗法相结合可启动依赖于CD8+T细胞和巨噬细胞的杀肿瘤免疫力。
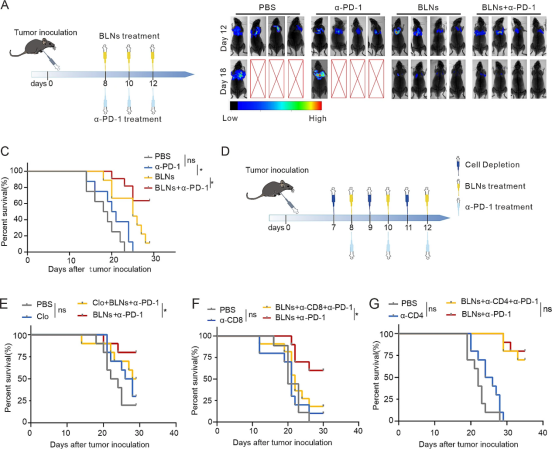
图6CD8+T细胞和巨噬细胞主导联合治疗效果
BLN可产生有效的免疫记忆,且具有安全的生物相容性
肿瘤抗原识别免疫记忆的形成决定了治疗的有效性,这取决于有效激活抗肿瘤免疫力以长期抑制肿瘤进展。因此,我们研究了BLN与α-PD-1疗法相结合是否可以促进免疫记忆的形成。在本研究中,CD3+CD4/CD8+CD44高CD62L高T细胞被门控为中央记忆T细胞(Tcm),CD3+CD4/CD8+CD44高CD62L低T细胞被门控为有效记忆T细胞(Tem)(图7A)。最后一次联合治疗后,所有小鼠都饲养至第60天以检查免疫记忆形成测试(图7B)。脾脏(图7C-F)或淋巴结(图7G-J)的CD4+T细胞或CD8+T细胞中的Tcm和Tem均显著增加。为了进一步验证体内免疫记忆效应,我们再次用LLC-Luc治疗5只治愈的MPE小鼠,以同龄幼鼠作为平行对照。所有幼鼠均发生MPE,而治愈小鼠未出现恶性肿瘤迹象(图7K)。此外,我们用治愈的MPE小鼠脾脏研磨液治疗LLC。LDH检测显示治愈组脾脏研磨液对肿瘤细胞的杀伤作用强于对照组。因此,总体而言,BLNs联合α-PD-1可以促进抗肿瘤免疫记忆的形成。
为了评估BLN与α-PD-1结合的生物相容性和安全性,我们收集了血液样本进行常规和生化分析,并收集了重要的器官组织(心脏、肝脏、脾脏、肺和肾脏)进行组织病理学染色。单一疗法和联合疗法均不会影响白细胞(WBC)、丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)的水平(图7L-N)。组织病理学检查显示这些器官正常,不受单一疗法或联合疗法的影响。总之,这些数据表明BLN可引发持久的免疫记忆,以可靠的生物安全性对抗恶性肿瘤进展。
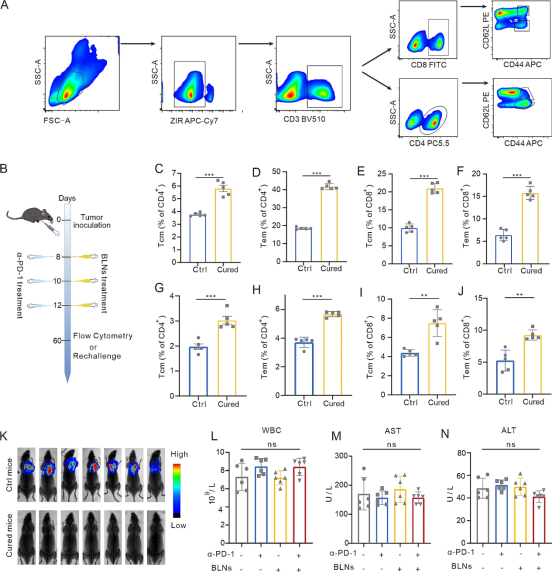
图7BLN可产生有效的免疫记忆,且具有安全的生物相容性
总结
综上所述,我们描述了一种新型辐照癌细胞衍生的BLN的开发和生物学功能(图8)。我们研究的主要发现是:BLN(1)具有良好的生物学特性,容易被癌细胞和TAM吞噬;(2)重塑癌细胞的免疫原性和TAM的表型,这是BLN增强抗癌免疫反应和逆转MPE对α-PD-1耐药性的关键机制;(3)与α-PD-1具有协同抗癌作用,导致MPE小鼠模型中的癌细胞完全消灭,并诱导免疫记忆效应;(4)具有良好的生物相容性,并可实现无化疗的癌症治疗,安全性高。此外,我们发现BLN可以模拟RT的生物学效应,从而为扩大RT的临床适应症提供了一种策略,从而将间接癌症RT应用于无法应用RT的癌症。因此,本研究提出了一种逆转免疫疗法耐药性的独特策略。
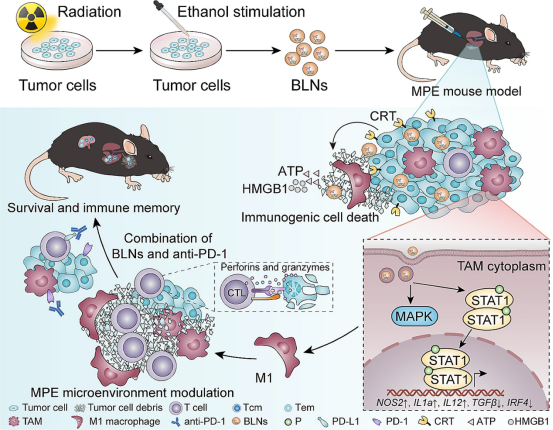
图8本研究探索的机制示意图
原文链接:https://link.springer.com/article/10.1186/s12951-024-02413-8#MOESM1

