脂质纳米颗粒(LNP)的制备方法及在基因治疗中的应用
引言
脂质纳米颗粒(LNP)是最成功的纳米递送载体之一,能够有效递送细胞毒性化疗药物、抗生素和核酸治疗剂。在冠状病毒病(COVID-19)大流行期间,辉瑞/BioNTech和Moderna成功开发了基于LNP的COVID-19信使RNA(mRNA)疫苗。基于这一成功,多种基于LNP的RNA疗法的开发正在获得动力,因为它在各种遗传疾病和癌症的疫苗和疗法中具有潜力。RNA疗法已在各种医学应用中显示出潜力,包括病毒疫苗、癌症免疫疗法和基因编辑。
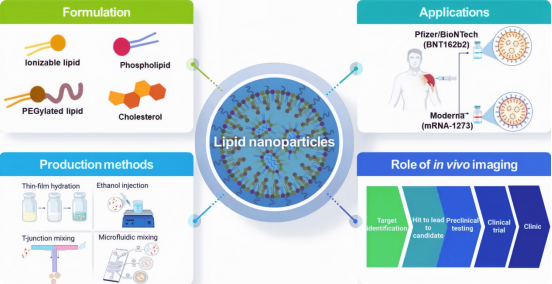
1.脂质纳米颗粒LNP的组份
使用mRNA作为新型治疗药物的想法最初由圣地亚哥的Vical Incorporated公司于1989年提出。将mRNA加载到LNP中是稳定的,从而可以成功递送到细胞中。LNP通常由四个不同的组件组成,这些组件具有如图2和表1所示的独特作用。
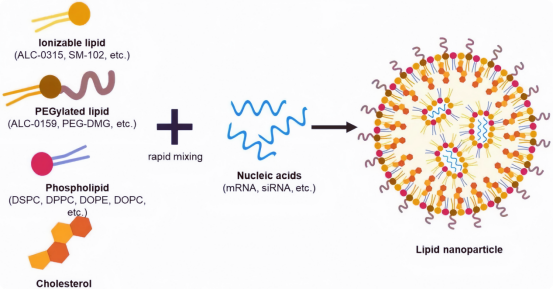
图2 脂质纳米颗粒及其成分的图示。 使用BioRender.com创建。
表1 LNP脂质成分及其功能
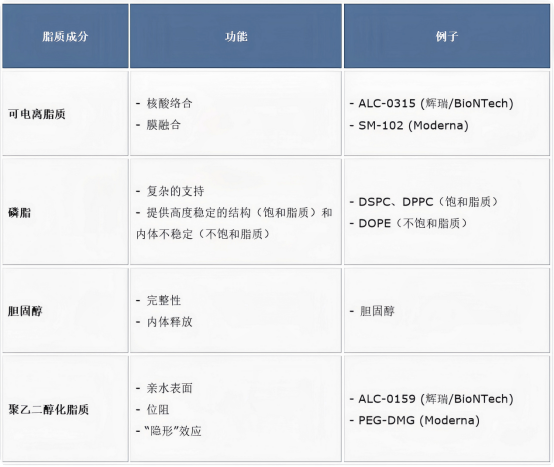
1.1可电离脂质
可电离脂质决定了LNP的效力,因为它在封装mRNA或其他不同类型的核酸方面发挥着至关重要的作用。一般来说,阳离子脂质含有烷基化季铵基团,因此脂质的电荷在不同pH下保持相同。另一方面,可电离脂质在低pH (<6.0)下形成正电荷,因为游离胺随着pH降低而质子化。
可电离脂质的这一特性为mRNA的递送提供了几个主要优势。首先,脂质电荷在不同pH下的转换能够实现mRNA的高封装效率,因为脂质的正电荷在低pH下与阴离子mRNA相互作用。因此,使用可电离脂质配制LNP在生理pH值下提供较少的正电荷或中性电荷,这不仅增强了纳米颗粒的生物相容性,而且有助于防止阴离子生物分子的非特异性结合。可电离脂质的电荷随环境pH值变化的能力被认为是LNP内体逃逸的关键组成部分。当内体成熟开始时,内体内部的低pH值将可电离的脂质转变为正电荷。这些带正电的可电离脂质与带负电的内体膜相互作用,形成六方(HII)相的非双层结构。当膜融合发生时,LNP中捕获的核酸逸出并释放到细胞质中。
1.2磷脂和胆固醇
LNP的其他成分是“辅助脂质”,即磷脂(即DSPC、DOPE等)和胆固醇。一般来说,这些辅助脂质不仅提供纳米颗粒的结构稳定性,还改善LNP的生物分布,并通过促进细胞内摄取和细胞溶质进入来增强递送效率。此外,根据磷脂的类型,它可能导致脂质双层的破坏,从而促进内体逃逸。
常用的磷脂之一是磷脂酰胆碱(PC),例如1,2-二硬脂醇-sn-甘油-3-磷酸胆碱(DSPC)和氢化大豆PC(HSPC)。DSPC在临床上得到应用,例如siRNA疗法(Patisiran)和针对SARS-CoV-2的mRNA疫苗(mRNA-1273和BNT126b2)。DSPC在脂质尾部含有饱和酰基链,含有一个或多个双键,并具有相对较大的头部基团,形成圆柱状几何形状。此外,这种脂质的高熔解温度(T m)值提供了高度稳定的LNP结构。由于其高度稳定性,它抑制与内体膜的膜融合,从而抑制内体逃逸。另一方面,DOPE被认为是一种融合脂质。它含有两个不饱和酰基链,尾部仅含有单键烃链,头部相对较小,形成圆锥形几何形状。这些不饱和酰基链脂质具有低熔点(T m)值并稳定非双层六方II相。在生理温度下,DOPE由于倒六方相而形成非层状脂质相。这使得膜融合、双层破坏成为可能,从而导致内体逃逸。此外,据报道,当DOPE存在于阳离子脂质制剂中时,可通过促进膜融合来增强转染功效。
胆固醇也用于LNP开发,因为它通过调节膜完整性和刚性来增强颗粒稳定性。Patel等人认为,由于胆固醇与C-24烷基植物甾醇类似,因此在增强mRNA-LNP的基因转染和生物分布方面具有重要作用。因此,帕特尔等人的研究报道,维持高转染需要 1) 羟基的极性,2) 甾醇环的灵活性,以及 3) 烷基尾的长度。还通过配制具有不同胆固醇摩尔比的脂质体,深入了解胆固醇在脂质体配制中的作用。由于胆固醇与DSPC的混合摩尔比不断增加(10~50 mol%),脂质体尺寸减小,表明胆固醇的量影响脂质体的尺寸。
1.3聚乙二醇化脂质
聚乙二醇化脂质在LNP配方和mRNA递送中具有多种作用。聚乙二醇化脂质的结构包含亲水性头部和疏水性尾部。聚乙二醇化脂质具有从400 Da到50 kDa的宽摩尔质量范围。因此,根据应用使用适当的摩尔质量很重要。LNP制剂中聚乙二醇化脂质的量决定了大小和zeta电位,这也是影响递送功效的重要特性。PEG的大摩尔质量,例如20至50kDa,应用于低摩尔质量的药物(例如寡核苷酸、siRNA、小分子等)的使用。使用大摩尔质量的PEG增加了药物载体的尺寸,使其能够避免肾脏清除。另一方面,较低摩尔质量的PEG,例如1 至 5 kDa,用于较大的药物:抗体和纳米颗粒药物。
此外,有许多研究报告表明聚乙二醇化脂质可增强稳定性并减少 LNP的聚集。因此,聚乙二醇化脂质可延长血液循环时间并保护LNP表面,从而减少肾脏的清除率。聚乙二醇化脂质还可以保护LNP免遭单核吞噬细胞系统 (MPS) 的摄取。由于聚乙二醇化脂质可防止聚集并控制LNP的大小,因此它们总体上提高了稳定性,同时可能降低 ApoE 吸附和颗粒融合性。聚乙二醇化脂质的“隐形效应”降低了蛋白质吸附以及LNP的细胞摄取和转染能力。
2.LNP的多种生产方法
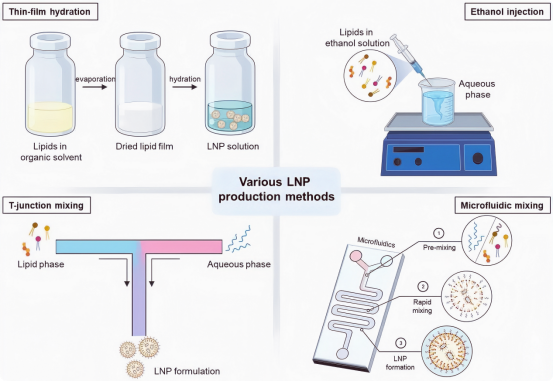
2.1薄膜水化法
阳离子脂质体是第一个用于mRNA疫苗的递送载体。薄膜水合或Bangham方法是脂质体生产最常用的技术之一。这种被动封装方法是在磷脂自发自组装成囊泡时产生的。由于脂质溶解在有机溶剂(例如乙醇或氯仿)中,因此脂质随后通过旋转蒸发器蒸发,从而形成薄的脂质层。当使用负载核酸的缓冲水溶液使薄层水合时,脂质的疏水性和亲水性部分会自组装。因此,它导致形成大的多层囊泡(MLV),其尺寸非常异质,尺寸为微米。使用薄膜水化方法的优点是:(1)它是最简单的制备过程,(2)它不涉及使用昂贵、复杂的实验室设备,(3)不需要高压或高温维护。
2.2乙醇注射液法
乙醇注射是形成单层脂质体的另一种通用技术。在该方法中,将脂质溶解在乙醇中,并在搅拌下快速注射到含有药物或用于包封的化合物的水性缓冲液中,其体积相对高于脂质溶液,迅速形成囊泡。使用乙醇注射方法的优点之一是操作简单方便。由于混合溶剂极性的增加,注射的脂质溶液被水性缓冲液快速稀释,从而形成自排列囊泡。这些囊泡的大小是通过脂质浓度、搅拌速率、注射速率和所用脂质类型来控制的。
另一种称为“错流注射”的乙醇注射方法是作为大规模生产脂质体的另一种方法而开发的。这种替代装置由两根十字形不锈钢管组成,在管之间的交叉处有一个小注射孔。通过错流管,通过改变氮气调节装置的压力,将含有脂质的乙醇溶液注入缓冲溶液中,形成脂质体。这些不同的乙醇注射方法使用高脂质浓度,并且由于异质纳米颗粒生产的尺寸大和mRNA封装效率低,这些制造生产方法并不普遍使用。此外,大规模的重复性很难实现,因为使用超声处理程序会降解脂质和药物含量。据报道,由于样品在超声处理过程中过热,脂质和药物含量发生了降解。
3.3 T行接头混合法
T形连接混合方法是大批量mRNA-LNP商业化生产的普遍选择。当每个入口碰撞时,T形接头通过注入两种不同的溶剂产生快速混合,从而产生湍流。此外,混合物的恒定速度也很重要。尽管有关可能影响LNP配方的不同因素的数据有限,但 Kulkarni 等人证明了配制LNP时混合溶液的流速比会影响尺寸和 PDI 值。在该研究中,T形连接混合用于生产封装无机疏水纳米颗粒、氧化铁的 LNP。结果表明,LNP的尺寸随着总流量的增加而减小。当总流量为10 mL/min时,观察到LNP的尺寸为75±6 nm,而当总流量为40 mL/min时,LNP的尺寸为36±2 nm。PDI值也受到流速的影响,因为与较高流速下PDI的较低值相比,较低流速下的PDI值较高。该结果表明,使用T形接头混合控制流量可以影响纳米颗粒制剂的特性。
mRNA-LNP可以使用T形连接混合来配制,该方法通常比通过传统脂质体方法进行包封具有更高的包封效率。然而,通过T形接头快速混合的高流速要求在实验室规模上并不是优选的,但在大规模生产中并不是优选的。此外,混合物取决于沟道长度和接触表面积。因此,传质影响的降低可能是由于T形连接混合的混合时间短造成的,这导致脂质聚集和纳米颗粒配方的不均匀性。尽管有一些关于通过T形接头混合生产LNP的报道,但仍需要进一步研究来确定影响LNP配方的各种因素。
3.4微流体混合法
典型的微通道操作条件是层流,分子在通道中扩散缓慢。缺乏湍流使得难以有效地混合溶液。与典型微通道的简单光滑通道相比,流体通道的附加结构促进了流体动力学分散的减少,从而实现了溶液的有效混合。此外,据报道,交错人字形结构的微流控芯片可以简单地扩展以生产大批量。图案结构微流控芯片的发展改进了混合过程的控制,从而实现了均匀颗粒尺寸和分布的控制以及与本体方法相比更高的封装性。通过交错人字形结构提供的快速混合突然增加了混合物的极性,从而导致过饱和,从而导致LNP的形成。据报道,控制总流量(TFR)和流量比(FRR)可以影响LNP的尺寸和尺寸分布,因此结构化微流控芯片是LNP生产中的合适应用。
3.LNP在基因治疗中的应用
遗传和许多后天形成的疾病都可以通过基因疗法进行治疗。核酸作为基因疗法中起主要作用的物质,是亲水性带负电荷的大分子,由于在生物体液中存在大量的核酸降解酶,导致其在单独使用时非常不稳定,极易被降解。其次,由于活性分子与生物膜之间的相互作用是启动进入细胞的必要条件,但这一过程不是自发的,因为核酸和细胞膜的负电荷表面阻碍了它们之间的相互作用,核酸亲水性也阻止了其自发地通过亲脂性的细胞膜。因而,全身注射裸核酸不会产生有效的治疗效果。但是 LNP 可以保护核酸在生物体液中不被降解,并已被证明了其可以通过靶向介导或内吞方式进入到目的细胞中。因此,LNP 基因递送系统被广泛地用于治疗包括癌症、传染病和眼部疾病等各种疾病。
3.1癌症的基因治疗
癌症已经成为全球第二大死因,当今研究癌症治疗的注意力主要集中在寻找致癌基因 上,并通过修正或沉默相关致癌基因来实现癌症治疗。目前所采用基于基因的治疗机制主要 有两个方面: 一方面,基因治疗可以在分子水平上直接影响致癌的特定基因; 另一方面,基因治疗可以通过识别易感基因来改善免疫系统而预防癌症。一般而言,由于肿瘤部位有缺陷的血管生成导致肿瘤血管具有高度渗透性,进而导致 LNP( 直径<200nm) 能在肿瘤部位积累。此外,肿瘤的特征是淋巴引流功能障碍,这会延长LNP 在肿瘤部位的滞留时间。因此,目前已经开发了多种 LNP 平台用来递送核酸以提升癌症的治疗效果。
3.2递送 mRNA 的疫苗
信使RNA( mRNA) 具有安全有效的蛋白质表达谱,在基因编辑或疫苗开发上具有良好的应用前景。LNP 可以有效地递送基于 mRNA 的疫苗,也是目前核酸药物递送领域应用较广泛的一种载体之一。其能保护 mRNA 免于降解并帮助 mRNA 在体内递送和在内涵体中逃逸,同时由于其包覆的 mRNA 比较容易被抗原细胞吸收,并引发强烈的体液和细胞免疫反应,因此其也常被用于递送疫苗,目前正在被开发用于递送多种COVID-19 疫苗。mRNA/LNP 疫苗也可以用于兽医领域以预防动物的传染病。 3.3体内基因组编辑 基因组编辑技术 CRISPR 已经成为一种强大的新工具,其能够永久修复致病基因突变,可以改变我们传统治疗疾病的方式。然而,该技术的应用面临的挑战主要是如何安全、有效和特异性地递送基因到需要治疗的组织或器官。一些研究表明使用 LNP 递送 CRISPR/Cas9 可实现持久的体内基因组编辑。
3.4肝病的基因治疗
肝脏疾病,包括遗传性代谢紊乱、慢性病毒性肝炎、肝硬化、原发性和转移性肝癌,由于其高患病率和目前治疗的局限性,构成了一个巨大的健康问题。全世界每年约有 8 亿遗传性代谢性肝病的病例,并导致超过 200 万人死亡。除肝移植外,目前没有有效的治疗方法,肝移植受供体短缺、成本、手术风险和长期免疫抑制的影响,因此,非常需要更安全和更有效的治疗手段。 非病毒载体可以满足这些需求,因为它们能够以最小的毒性和免疫原性更特异地向肝脏输送基于基因的药物。利用位于肝细胞膜上特殊的如胶原 VI 型受体、甘露糖 6-磷酸受体等膜受体,通过靶向修饰的非病毒载体,特别是靶向 LNPs,可以递送 siRNA、mRNA、DNA 或基因编辑复合物,从而通过沉默致病基因,表达治疗性蛋白质或纠正遗传缺陷,在肝病中显示出潜在的治疗效果。
参考文献 [1]Jung HN, Lee SY, Lee S, Youn H, Im HJ. Lipid nanoparticles for delivery ofRNAtherapeutics: Current status and the role of in vivo imaging. Theranostics 2022; 12(17):7509-7531. doi:10.7150/thno.77259. https://www.thno.org/v12p7509.htm
[2]《脂质纳米颗粒的制备及在基因治疗中的应用》

