林文斌团队提出纳米药物超越EPR效应新策略
增强的通透性和滞留(EPR)效应一直被用于解释纳米颗粒在肿瘤组织中比化疗药物更能增加药物沉积的能力。这种效应是由于肿瘤特有的血管渗漏和肿瘤微环境(TME)中低效的淋巴引流导致的长循环纳米颗粒的被动积累。大小在10到200纳米之间的纳米颗粒可以避免通过肾脏滤过(<10纳米)和单核吞噬系统(MPS)(>200纳米)清除,并通过EPR效应积累在肿瘤中。然而,癌症纳米药物的低成功率引发了关于EPR效应在增强药物在肿瘤中沉积的作用以及EPR效应在人类肿瘤中普遍性的争论。肿瘤血管高度异质,具有可变的血管渗透性、血管成熟度、细胞外基质和间质液压力。纳米颗粒对药代动力学的改善不足以显著减轻化疗药物的全身沉积和总体毒性。因此,亟需开发临床相关的策略来调节和重塑极其异质的肿瘤微环境(TME),特别是肿瘤血管,以增加肿瘤药物沉积并改善化疗药物的治疗指数。
干扰素基因刺激剂(STING)通路在细胞应激或感染时介导炎症,并通过感知病原核苷酸激活先天免疫反应。双链DNA通过变构调节环鸟苷单磷酸-腺苷单磷酸合酶的催化活性,在细胞质中生成2′,3′-cyclic GMP-AMP(GA)。GA随后在内质网中与STING二聚体结合,导致STING聚合和转运,进而诱导I型干扰素(IFNs)和其他促炎细胞因子的分泌。过度活化的STING已被证明会导致一种以严重血管炎和血管病为特征的自身免疫疾病。STING在TME中的恶性和健康细胞中均有表达,包括内皮细胞(ECs)、血小板和高内皮静脉,这些细胞共同构成了肿瘤血管。STING的激活可以显著破坏TME中的异常血管模式。然而,强效环状二核苷酸(CDN)STING激动剂如GA,由于快速的酶降解和不理想的药代动力学,被迅速清除出血液循环。CDN STING激动剂如ADU-S100和MK-1454的肿瘤内注射由于其在肿瘤中的富集能力差,表现出极为有限的临床效果。
近日,芝加哥大学林文斌团队在Science Advances发文,题为STING activation disrupts tumor vasculature to overcome the EPR limitation and increase drug deposition。研究利用纳米配位聚合物(NCP)共负载STING激动剂(2‘3’-cGAMP, GA)和化疗药物奥沙利铂(OX),即OX/GA,以克服EPR效应的限制,并通过STING介导的肿瘤血管破坏显著增加药物在肿瘤中的沉积,并实现肿瘤特异性的免疫应答引发强效的抗肿瘤作用。

NCP由无毒的磷酸锌亲水内核和含有聚乙二醇(PEG)等磷脂表层组成的核壳结构,可以将磷酸化的OX前药与GA通过与锌离子配位聚合封装在纳米尺度的内核中,从而提高药物的系统循环时间和药代动力学表现。通过在配位聚合物核心中保护GA免受降解,OX/GA显著延长了GA的血液循环时间。研究团队发现OX/GA能够破坏肿瘤血管,进而增强GA和OX在肿瘤中的积累。OX/GA使OX在肿瘤中的曲线下面积(AUC)增加了4.9倍,显著超越了单药纳米颗粒(OX-NCP)通过EPR效应实现的肿瘤富集水平。研究还发现,这种破坏肿瘤血管的效果主要依赖于肿瘤内皮细胞(ECs)中强效激活STING,而与STING激活后所分泌的促炎细胞因子无关。OX/GA在多种临床前癌症模型中均表现出强效的抗肿瘤作用,包括皮下的结直肠癌(MC38, CT26)、原位的胰腺癌(Panc02)、转移性的三阴乳腺癌(4T1)以及自发前列腺癌转基因(TRAMP)模型等。
在进一步的抗肿瘤机制研究中,通过ICP-MS分析注射后24小时内OX/GA在MC38肿瘤中的细胞分布,发现肿瘤细胞和髓样细胞分别摄取了59.4%和17.9%的OX/GA,而T细胞只吸收了0.3%。髓样细胞优先摄取OX/GA,摄取效率是肿瘤细胞的4.5倍。OX/GA的分布确保了对癌细胞的高效化疗作用和对免疫细胞的GA递送以激活STING。在确定OX/GA在不同细胞系中的细胞毒性时,发现OX/GA对MC38肿瘤细胞有毒,但对巨噬细胞和树突状细胞毒性很小。OX负载的NCP诱导MC38细胞的免疫原性死亡(ICD),并产生损伤相关分子模式(DAMPs)和肿瘤相关抗原(TAAs)。因此,OX/GA作为一种双功能纳米平台,既能有效杀死肿瘤细胞释放肿瘤相关抗原(TAAs),又能递送GA以激活抗原呈递细胞,实现肿瘤相关抗原呈递。
研究团队还分析了治疗后24小时内肿瘤中的促炎细胞因子水平,发现OX/GA显著刺激了IFN-β、IFN-γ、IL-6、TNF-α和CCL2的分泌。通过流式细胞术和t-SNE降维分析显示,OX/GA处理组肿瘤细胞显著减少,肿瘤浸润的先天免疫细胞显著增加,特别是DCs、巨噬细胞(包括M1样巨噬细胞)和粒细胞。巨噬细胞从M2样表型转变为M1样表型,M1/M2比例比PBS组高3.7倍。此外,OX/GA和GA-NCP处理显著增加了肿瘤中的粒细胞和自然杀伤(NK)细胞的浸润。这些结果表明,OX/GA通过招募先天免疫细胞并将抗炎亚群重新极化为抗肿瘤状态,刺激了强大的先天免疫反应。研究团队进一步评估了OX/GA诱导的适应性抗肿瘤免疫,结果显示OX/GA处理组的T细胞、CD4+ T细胞和CD8+ T细胞数量显著增加,同时B细胞浸润也增加了2.3倍。由于OX/GA激活了免疫浸润并创造了T细胞浸润的TME,在对抗PD-L1治疗无反应的冷Panc02肿瘤模型中,OX/GA联合抗PD-L1治疗有效抑制了肿瘤生长,并将中位生存期从38.5天显著延长至58.8天。这些结果表明,OX/GA使免疫“冷”肿瘤对免疫检查点疗法敏感。
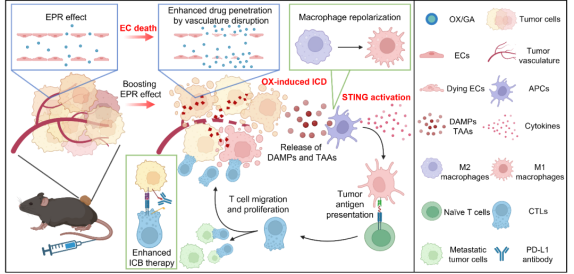
最后,OX/GA作为肿瘤靶向纳米载体,结合了STING激动剂和强效ICD诱导化疗药物,诱导强效的内皮STING激活,破坏肿瘤血管,增强OX和GA在肿瘤中的积累,克服EPR效应的限制。OX/GA强效诱导ICD,释放TAAs和DAMPs,刺激肿瘤中促炎细胞因子的释放,增强肿瘤抗原呈递,逆转免疫抑制,激活T细胞抗肿瘤免疫应答。NCPs为开发有效的癌症治疗提供了全新的多元化平台,为临床上的难治性肿瘤提供了新的治疗策略。
原文链接:https://www.science.org/doi/10.1126/sciadv.ado0082

