纳米材料在肿瘤免疫治疗中的应用:新策略与挑战
肿瘤免疫治疗通过刺激和增强机体的免疫反应发挥抗肿瘤作用,已成为抗肿瘤治疗的另一种重要方式,具有显著的临床疗效,与化疗、放疗和靶向治疗相比具有优势。尽管出现了各种肿瘤免疫治疗药物,但这些药物在递送过程中面临的挑战(例如肿瘤渗透性差和肿瘤细胞摄取率低)阻碍了它们的广泛应用。近年来,纳米材料因其靶向性、生物相容性和功能性而成为治疗不同疾病的一种手段。此外,纳米材料具有克服传统肿瘤免疫治疗缺陷的各种特性,例如药物负载量大、肿瘤靶向性精确和易于修饰,从而在肿瘤免疫治疗中得到广泛应用。本综述中提到的新型纳米粒子主要有两类:有机(聚合物纳米材料、脂质体和脂质纳米粒子)和无机(非金属纳米材料和金属纳米材料)。此外,还介绍了纳米粒子的制备方法——纳米乳液。综上所述,本篇综述文章主要讨论了近年来基于纳米材料的肿瘤免疫治疗的研究进展,为未来探索新的肿瘤免疫治疗策略提供了理论基础。
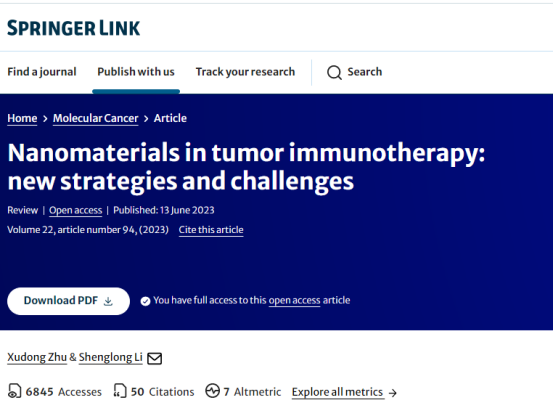
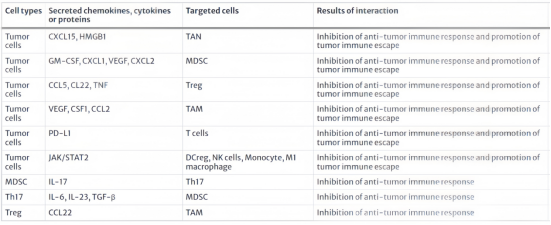
恶性肿瘤是全球范围内最危及生命的疾病之一。尽管分子分型和综合治疗方案的出现极大地改善了患者的生存结果,但局部复发和远处转移仍然是导致癌症相关死亡的主要因素。因此,研究人员正致力于开发能够抑制肿瘤复发和转移的有效治疗方法。目前,手术、化疗、放疗、靶向治疗和免疫治疗是肿瘤治疗的常用方式。这些治疗方法在早期就取得了积极的生存结果,肿瘤常常产生耐药性,从而导致肿瘤复发和转移微环境(TME)在肿瘤进展中起着重要作用。TME由肿瘤细胞、肿瘤相关成纤维细胞、内皮细胞、神经元、细胞因子、生长因子、细胞外囊泡、Treg细胞、CD8+T细胞和其他相关免疫细胞组成,它们共同参与肿瘤的侵袭和转移(图1)。TME内部发生的变化除了影响免疫治疗的有效性外,还会导致癌症的免疫逃逸(图2),最终导致肿瘤进展和死亡,表1总结了肿瘤细胞与免疫细胞之间的相互作用,通过抑制抗肿瘤免疫反应和诱导肿瘤微环境中的免疫逃逸来促进肿瘤的侵袭和转移。
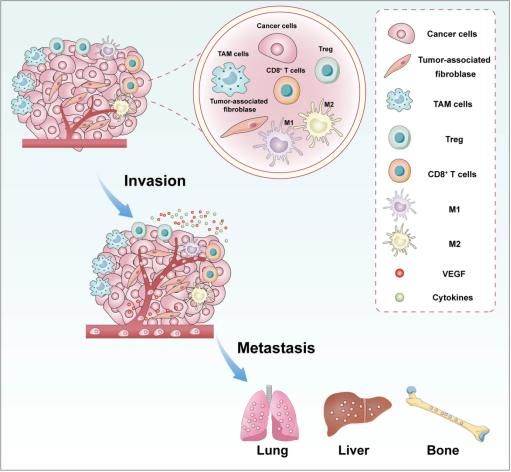
图1肿瘤微环境的基本条件
图2癌细胞与肿瘤微环境之间的相互作用有助于癌症免疫逃逸
表1
此外,肿瘤免疫治疗还可以减弱或抑制TME或肿瘤细胞诱导的免疫抑制信号。目前,肿瘤免疫治疗中应用最广泛且被证实有效的策略是利用免疫检查点抑制剂,如CTLA-4抗体、PD-1抗体和嵌合抗原受体T细胞(CAR-T),这些药物在治疗多种实体瘤和血液系统恶性肿瘤方面表现出强大的抗肿瘤活性(图3)。多种肿瘤免疫治疗药物已成功进入临床应用。然而,由于肿瘤渗透性差、肿瘤细胞摄取率低,肿瘤免疫治疗药物在体内仍面临几个关键挑战。首先,药物可能导致特异性T细胞的产生,而这些T细胞无法有效直接靶向肿瘤细胞;其次,无法诱导持续的抗肿瘤免疫反应以发挥长期的保护作用。一些研究进一步探讨了免疫治疗药物无法产生特异性和高效T细胞的潜在机制,并提出了克服这些缺陷的相关方法。
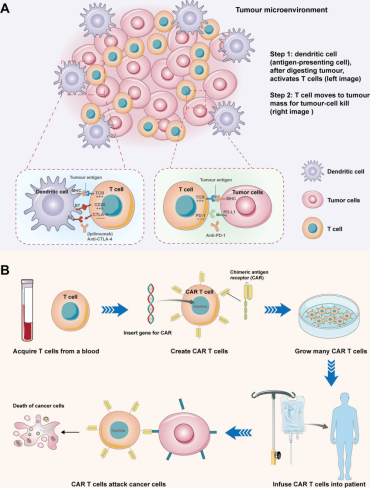
图3CTLA-4抗体、PD-1抗体、CAR-T等免疫检查点抑制剂在肿瘤免疫治疗中的应用
纳米材料是指结构尺寸介于1至100纳米之间的物质。纳米材料具有明显不同于一般材料的特殊热学、生物和电磁特性,如表面效应、量子尺寸效应和宏观量子隧道效应其中许多纳米材料(如金属和金属氧化物纳米颗粒)被发现具有独特的抗肿瘤特性,从而展示了纳米材料在肿瘤治疗中的巨大潜力。纳米粒子主要分为两大类:有机(聚合物囊泡、树枝状聚合物、聚合物胶束、纳米球、纳米水凝胶、脂质体和脂质纳米粒子)无机(非金属纳米材料、金属纳米材料等)。本综述主要讨论了肿瘤免疫治疗中常用的纳米粒子类型,包括有机类的聚合物纳米材料(聚乳酸-乙醇酸共聚物和水凝胶纳米粒子)、脂质体和脂质纳米粒子;无机类的非金属纳米材料和金属纳米材料。我们还介绍了纳米粒子的制造方法:纳米乳液。(图4)显示了本综述中提到的不同纳米材料模型和纳米粒子制造方法的示意图。本文着重对涉及上述纳米材料的肿瘤免疫治疗策略的研究进展进行综述,以期在不久的将来取得突破。
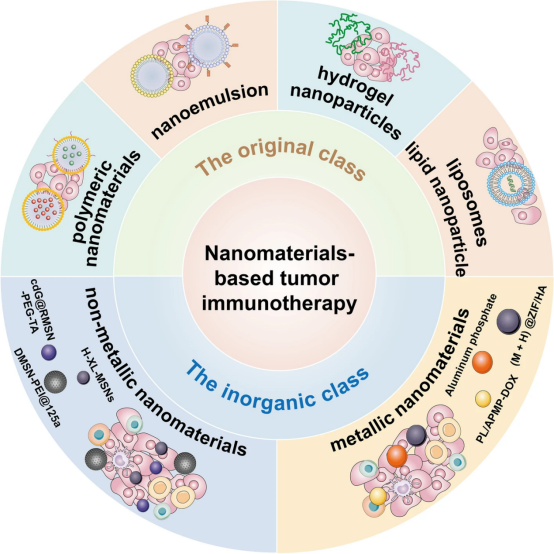
图4不同纳米材料模型和纳米粒子制造方法的示意图
基于有机纳米材料的肿瘤免疫治疗
聚合物纳米材料
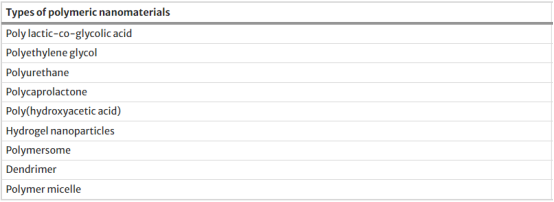
天然和合成的药物相关的聚合物纳米材料,例如聚乳酸-乙醇酸共聚物(PLGA)、聚乙二醇、聚氨酯、聚己内酯(PCL)、聚羟基乙酸、水凝胶纳米颗粒等,由于其良好的生物降解性、较大的比表面积、较低的细胞毒性和易于改性的特性,被广泛应用于组织工程、组织再生、药物控释和肿瘤免疫治疗领域。表2总结了已报道的不同类型的聚合物纳米材料。
表2
在各类聚合物纳米材料中,PLGA是一种合成的聚合物基纳米复合材料,具有良好的生物相容性、可降解性,具有缓控释放、保护DNA质粒环不断裂、包封率高、作为DNA疫苗载体不易被溶酶体降解等优点。Soodabeh等人研究发现从新鲜乳腺肿瘤中可获得含有肿瘤裂解物抗原的PLGA纳米粒子(PLGA-NPs)。相关实验证实PLGA-NPs可作为肿瘤抗原递送载体,有效刺激树突状细胞(DC)的成熟,PLGA-NPs还能对肿瘤抗原进行靶向递送和缓控释放。利用双溶剂蒸发技术,可以将树突状细胞负载到可溶性肿瘤裂解物中,然后将裂解物封装在纳米颗粒中,作为一种树突状细胞疫苗。此外,纳米颗粒包裹的抗原可以使T细胞的抗肿瘤免疫反应偏向Th1,从而增强这些树突状细胞疫苗的效果。陈真真等人将卵清蛋白和硫化铜负载到PLGA-NPs中,形成核壳结构的纳米复合物(cuS@OVA-PLGA-NPs)。他们发现cuS@OVA-PLGA-NPs可以激活CD8+T细胞并通过诱导IL-6、IL-12和TNF-α的表达来诱导抗肿瘤免疫反应。这一结果表明cuS@OVA-PLGA-NPs可以成为一种用于肿瘤免疫治疗的治疗性纳米材料.YongwhanChoi等人制备了不同分子量的PLGA-NPs,然后将阿霉素(DOX)负载到这些PLGA-NPs中,形成具有不同控释动力学的DOX-PLGA-NPs。临床前实验表明,DOX-PLGA-NPs是一种免疫原性细胞死亡(ICD)诱导剂,将其导入CT-26肿瘤细胞中,通过细胞毒性和HMGB1释放,以及诱导ICD,显著抑制体内CT-26肿瘤的生长。诱导ICD的原因可能是DOX-PLGA-NPs纳米药物相关的控释动力学可能通过释放损伤相关分子模式(DAMPs)显著刺激肿瘤细胞特异性免疫反应,从而在体内产生不同的抗肿瘤反应。此外,他们还发现,基于ICD的特异性抗肿瘤免疫反应在小鼠肿瘤模型中也成功建立了免疫记忆效应,包括促进DC成熟和增加细胞毒性T淋巴细胞的肿瘤浸润。ICD诱导的纳米材料负载化疗药物的控制释放可能通过控制肿瘤特异性免疫反应为精准癌症免疫治疗的发展提供巨大潜力,从而显著提高临床治疗效果。这些发现如(图5)所示。
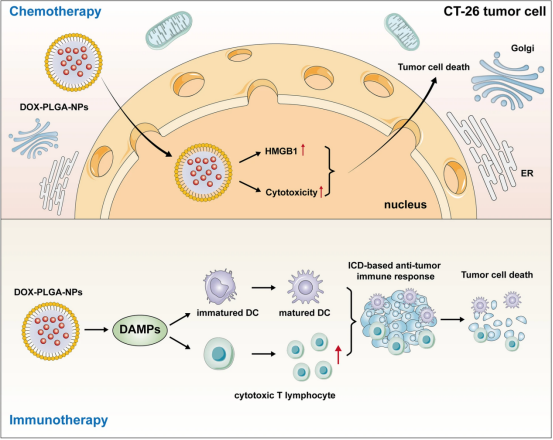
图5DOX-PLGA-NPs通过诱导化疗和免疫疗法的作用来对抗肿瘤
水凝胶纳米粒子是另一种尺寸为1至1,000纳米的聚合物纳米粒子,具有以下特点:良好的生物相容性、高度的结构可设计性、高保水性和可生物降解性。它们由内部交联结构组成,水是其主要分散介质。水凝胶纳米粒子具有许多有利的性质:体积效应、表面效应、界面效应、渗透效应、尺寸效应等。这些优势有利于它们获得大量活性位点以与各种功能成分偶联。
口服水凝胶是肿瘤免疫治疗中一个相对较新的策略。Xiao等人构建了基于SDT的口服水凝胶纳米马达(NM)CS-ID@NMs,它不仅是非侵入性的,而且具有很强的组织穿透能力。此外,CS-ID@NMs还能诱导ICD并激活肿瘤细胞清除中的免疫反应。CS-ID@NMs还利用结肠癌细胞膜上高表达的CD44的靶向能力来抑制肿瘤侵袭和迁移的能力。口服后,NMs从CS-ID@NM/水凝胶中释放出来,使其穿透粘液层并进入肿瘤组织。随后,这些NMs通过CD44介导的内吞作用被内化到结肠癌细胞中。IDs随后从这些NMs中快速释放出来,优先在癌细胞中聚集,随后Mn2+介导对肿瘤细胞的杀伤,并产生肿瘤碎片,从而激活后续的免疫反应。上述纳米水凝胶用于肿瘤免疫治疗抑制肿瘤进展的概况如(图6)所示。
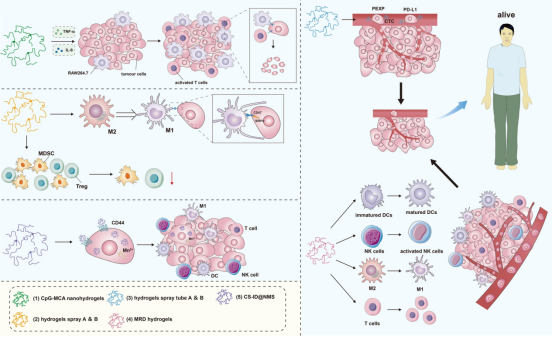
图6纳米水凝胶在肿瘤免疫治疗中抑制肿瘤进展的综述
脂质体
脂质体是具有双层膜的球形囊泡。双层膜由分散在水介质中的磷脂自发形成。这些脂质体的两亲性质使其成为优异的药物载体免疫原性和生物降解性,所有这些都使其在负载药物的靶向递送和缓释方面具有优势。除此之外,脂质体还可以通过提高药物稳定性、增强药物溶解度和降低药物毒性来改善负载药物的治疗效果。脂质体的基本作用方式如(图7)所示。
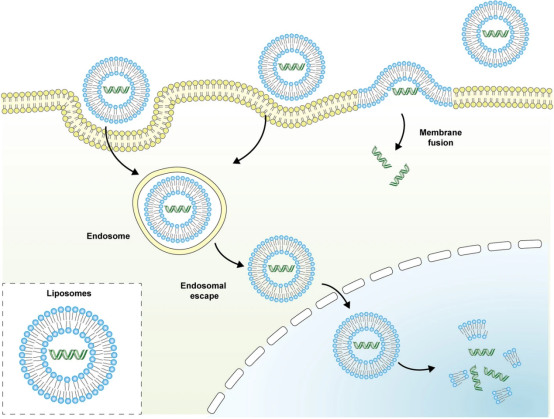
图7脂质体的基本作用方式
FengyunShen等人通过自组装奥沙利铂前药(Oxa(IV))设计并开发了一种脂质体aNLG/Oxa(IV)-Lip。Oxa(IV)与磷脂结合,并与NLG919(aNLG)和其他相关的商业脂质烷基化。这种新型脂质体通过增加CD8+T细胞的浸润水平、诱导细胞毒性细胞因子的分泌和降低免疫抑制性T细胞比例表现出抗肿瘤作用。MaryamKatehShamshiri等人构建了非聚乙二醇化(HSPC/DSPG/Chol,LIP-F1)脂质体和聚乙二醇化(HSPC/DSPG/Chol/mPEG2000-DSPE,LIP-F2)脂质体,其中包含IFN-γ。用这类新型脂质体处理M2巨噬细胞,能有效提高一氧化氮(NO)水平,降低精氨酸酶水平,还能通过增加转运到免疫细胞中的IFN-γ水平,诱导强烈的抗肿瘤免疫反应。胡梅等设计并开发了一种新型脂质体DOX@LINV。DOX@LINV是通过将人工脂质体与相关肿瘤来源的纳米囊泡融合而构建的,然后在该融合脂质体上装载DOX。这种新型融合脂质体DOX@LINV能刺激树突状细胞成熟,诱导抗原特异性T细胞的抗肿瘤免疫反应,从而对肺癌、乳腺癌和黑色素瘤发挥抗肿瘤作用。苏奇等构建了阳离子聚合物-脂质杂交纳米囊泡,它可以显著刺激树突状细胞成熟并提高树突状细胞的疫苗摄取能力。此外,这种新型脂质体还能增加CD8+T细胞的浸润水平并引流肿瘤淋巴结,预示它可以成为一种良性的肿瘤免疫治疗方法。李金波等人开发了一种可以负载紫杉醇、蒽环类药物米托蒽醌或DOX的脂质体。这种新型脂质体可以诱导ICD和肿瘤细胞杀伤,从而抑制肿瘤的发展。程莉莉等人设计并开发了一种名为hGLV的治疗性纳米囊泡。hGLV是通过将工程外泌体与载药脂质体融合而开发的。CD47在hGLV中过表达,可通过抑制CD47相关信号来改变巨噬细胞介导的肿瘤细胞吞噬模式。此外,静脉注射后,负载光热剂的hGLV可在激光照射作用下促进肿瘤细胞达到最佳PTT,从而彻底消除肿瘤,并可导致ICD,并可促进大量肿瘤相关抗原的产生,刺激DC的成熟。JiEunWon等研制出一种唾液酸(CA-SAL)修饰的绿原酸脂质体,并将其与抗PD1抗体联合用于黑色素瘤患者的肿瘤免疫治疗,可有效降低M2型巨噬细胞与CD4tFop3tT细胞的比例,显著升高CD8+T细胞与M1型巨噬细胞的比例并伴随T细胞的活化,并表现出协同抗肿瘤作用,可为黑色素瘤患者提供一种新的治疗方法。他们还研制出了一种含有金簇标记DOX脂质体(CH-HG-GLDOX)的壳聚糖水凝胶(CH-HG),CH-HG-GLDOX可有效抑制肿瘤的生长和存活,并降低DOX在体内的细胞毒性。CH-HG-GLDOX与聚(D,L-丙烯-乙醇酸)纳米颗粒疫苗联合使用,可产生协同抗肿瘤治疗作用。王月华等研制了一种以氧饱和的全氟己烷(PFH)为核心的脂质体,并在脂质体表面修饰CXCR4拮抗剂LFC131肽。此外,该脂质体还用于在肝细胞癌中递送索拉非尼和CSF1/CSF1R抑制剂PLX3397(PFH@LSLP),显示出良好的治疗效果。PFH@LSLP可以识别缺氧相关的CXCR4过表达,阻断信号SDF-1α/CXCR4轴激活CD8+T细胞的抗肿瘤免疫反应并逆转免疫抑制TME,最终阻止肝细胞癌的发展。上述脂质体在肿瘤免疫治疗中用于抑制肿瘤进展的应用总结如(图8)所示。
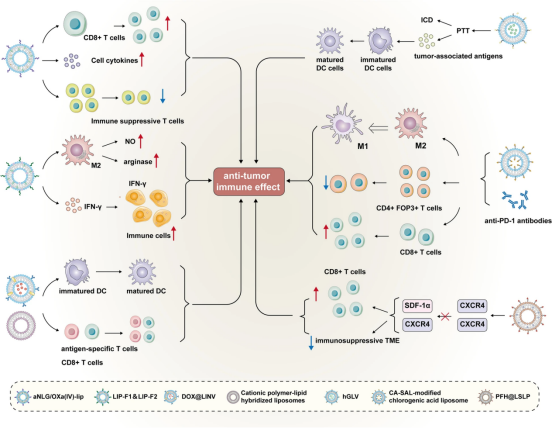
图8脂质体在肿瘤免疫治疗中抑制肿瘤进展的应用
脂质纳米颗粒
脂质纳米粒(LNPs)是一种具有优异药物递送能力的新兴纳米材料,在肿瘤治疗领域得到了广泛的研究NLC)。LNPs的优点包括生物相容性、抗肿瘤药物的控释和缓释、较低的全身毒性,尤其是在递送mRNA进行肿瘤免疫治疗方面具有优势。对于LNPs的成分,典型的LNPs由阳离子脂质、可离子化脂质或辅助脂质组成。也可以添加聚乙二醇(PEG)脂质或表面活性剂来提高LNPs的胶体稳定性。目前,LNPs的潜在临床应用主要在于有效调节mRNA的递送以提高免疫治疗效果。裸露的mRNA不稳定,可被核酸酶快速降解并发生自水解。LNPs包裹mRNA可保护裸露的mRNA免受细胞外核糖核酸酶的损伤,并有助于细胞内的mRNA递送。因此,这些mRNA的治疗作用可得到充分发挥。许多研究已经证实了这一点。
基于纳米乳液的肿瘤免疫治疗(一种有机纳米粒子的制造方法)
纳米乳液(NEs)属于胶体分散体系,由表面活性剂稳定。NEs的平均粒径为20—200纳米。与传统乳液不同,NEs粒径更小,界面性质、透明度和动力学稳定性更好。将生物活性成分封装到NEs中可显著提高其生物功效和物理化学稳定性。
BijunZeng等人设计并开发了一种新型功能化定制NE,其包裹靶向Clec9A的肿瘤相关抗原(Clec9ATNE)。Clec9ATNE包裹了六个新表位,并在CD4+T细胞的帮助下显著抑制了B16-F10黑色素瘤的生长。Sun-YoungKim等人开发了一种局部原位疫苗,其中肿瘤抗原以负载TLR7/8激动剂的NE为佐剂。这种以NE为佐剂的疫苗可显著诱导先天免疫细胞的激活,增加淋巴细胞的浸润水平,促进M2巨噬细胞的极化,从而有助于抑制肿瘤生长并改善肿瘤小鼠的生存结果。XiuminZhang等人利用磁超声技术构建了一种由NE包裹的复合蛋白疫苗(M1M3MnH)。NEs(M1M3MnH)能诱导比M1M3MnH、NE(-)或PBS更强的抗肿瘤免疫反应,表明这种新型NEs载体对包埋抗原具有强大的抗肿瘤免疫作用。ChangLiu等构建了NEs系统(SSBNMs)来共同递送TGF-β抑制剂和硒半胱氨酸(SeC)以增强T细胞的免疫反应。SSBNMs提高了NK92细胞表面NKG2DL的表达水平,进而通过TGF-β/TGF-βRI/Smad信号通路增强抗肿瘤免疫反应。此外,SSBNMs可以持续释放TGF-β抑制剂和SeC,并与NK92细胞协同作用,产生良好的抗肿瘤免疫反应。LeJia等设计了一种NEs(PNE)-D/HY@PNE,将ICD抑制剂HY19991(HY)和DOX递送到特定部位。D/HY@PNE可以快速释放载有HY和DOX的纳米凝胶,从而增强穿透能力和ICD诱导,最终提高对4T1肿瘤小鼠的抗肿瘤效果。张一帆等人设计并开发了一种表达PD-1的模拟NE。在这种NE中,全氟化碳可以提供氧气来对抗缺氧肿瘤,也可以作为光动力疗法(PDT)的来源。此外,这种表达PD-1的模拟NE可以一起递送PD-1蛋白和光敏剂,有助于PDT和免疫疗法的协同作用。然后,PDT可能通过刺激DC成熟和增加细胞毒性T淋巴细胞的浸润水平来抑制肿瘤的生长和转移。JiaeKoh等人设计了一种含有TLR7/8激动剂NE(R848)的疫苗。该疫苗可通过激活T细胞和抑制T细胞耗竭来诱导抗肿瘤免疫反应,并防止肿瘤复发和转移,从而改善肿瘤小鼠的生存结果。上述NE在肿瘤免疫治疗中用于抑制肿瘤进展的总结如(图9)所示。
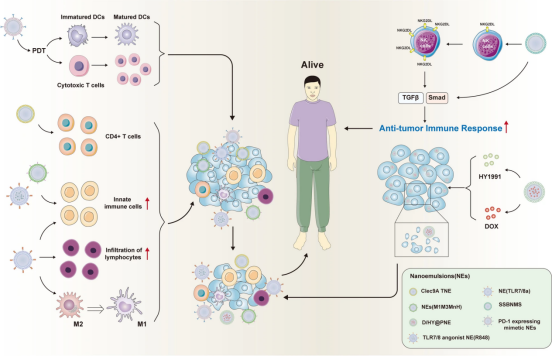
图9NE在肿瘤免疫治疗中抑制肿瘤进展的作用
基于无机纳米材料的肿瘤免疫治疗
无机纳米材料具有形状和尺寸可控、化学性质明确以及优异的光学、电学和磁学性质,在肿瘤免疫治疗方面具有巨大优势。无机纳米材料主要包括非金属纳米材料和金属纳米材料。
非金属纳米材料
通过制备SiO2实心纳米球,将OVA共价结合到活化的SiO2表面,构建了纳米疫苗OVA@SiO2。OVA@SiO2可以刺激骨髓来源的DC成熟。还构建了具有超大中孔的中空介孔二氧化硅纳米粒子(H-XL-MSN)。在H-XL-MSN表面应用PEI溶液可以促进DC成熟,并显著提高细胞毒性T细胞的比例,最终抑制肿瘤的生长和存活。 金属纳米材料 磷脂包裹的无定形多孔磷酸锰药物纳米载体(PL/APMP-DOX)是一种已应用于肿瘤免疫治疗的锰基混合纳米颗粒。由于表面磷脂的修饰,药物纳米载体PL/APMP-DOX在体内血液中保持完整,并可在表达高水平磷脂的4T1小鼠乳腺癌细胞中分解。APMP-DOX将进一步分解,其中Mn2+和DOX被释放到细胞内微环境中。释放的DOX导致DNA泄漏,随后激活GMP-AMP-cGAS-STRING通路。PL/APMP-DOX与Mn2+增强的STRING通路活性一起,促进I型干扰素的产生、树突状细胞的成熟,并增加细胞毒性T淋巴细胞或自然杀伤细胞的数量,从而增强杀死肿瘤细胞的细胞毒作用。此外,PL/APMP-DOX还能大大增强促炎细胞因子的分泌,抑制肿瘤的进展。此外,CaP可用于包裹细菌的外膜囊泡(OMV),激发强大的免疫刺激能力。pH敏感的CaP壳促进巨噬细胞从M2极化为M1,有助于抗肿瘤免疫。Moon等人还构建了基于Mn2+和CDNSTING激动剂的自组装纳米颗粒CMP。还制备了CMPCDA,其可以显著增强STING激动剂IFN-I的活性。体外实验表明,CMPCDA易于被BMDC摄取,并促进BMDC分泌IFN-β。体内实验结果表明,CMPCDA通过提高IFN-β、TNF-a、CXCL10和CCL5的水平,增强荷瘤小鼠的CD8+T细胞应答,显著抑制肿瘤生长。
原文链接:https://link.springer.com/article/10.1186/s12943-023-01797-9

